Механизм действия лучевой терапии
Основная цель радиотерапии — повреждение малигнизированных клеток ионизирующим излучением с минимальным влиянием на здоровые окружающие ткани. В клинической практике используют различные типы излучения от различных источников, например рентгеновское и гамма. Место опухоли визуализируется в виде трехмерной компьютерной модели из результатов компьютерной или магнитно-резонансной томографии. Распределение лучей можно спланировать таким образом, чтобы минимальная доза (для рака простаты 74–80 Гр) достигалась во всей малигнизированной ткани с минимальным влиянием на чувствительные к радиации органы — мочевой пузырь и кишечник. Различают терапевтическую и паллиативную лучевую терапию. Последняя используется для облегчения симптомов, возникающих на терминальных стадиях. При раке простаты терапевтическая форма применяется в качестве альтернативы хирургии — радикальной простатэктомии.

При конформной чрескожной радиотерапии проводится трехмерное планирование выбранного объема облучения, что уменьшает риск развития поздних осложнений.
Контактная терапия
Иное название контактной терапии – брахитерапия. Применяется на ранних стадиях возникновения патологии. Принцип применения заключается в том, что источник радиоизлучения подводят к непосредственным поражённым тканям и клеткам при помощи подкожных инъекций. Достигается эффект максимального облучения клеток новообразования при минимальном риске возникновения побочных эффектов и повреждения радиацией соседних здоровых тканей и органов.
Выделяют два варианта осуществления брахитерапии, в зависимости от состояния больного и стадии онкологического процесса:
- вариант с высокой дозой радиоактивного излучения;
- вариант с низкой дозой радиоактивного излучения.
При выборе первого метода учитываются показатели специального онкомаркера в сыворотке крови больного – простатический специфический антиген. Он применяется для диагностики и наблюдения за течением рака простаты и аденомы простаты – доброкачественной гиперплазии предстательной железы.
Главное преимущество применения метода с высоким уровнем ионизирующего облучения – это применение в терапевтических целях очень мощного и короткого импульса заряженных радиационных частиц. Именно поэтому этот вариант терапии не используется при проведении дистанционной терапии. В течение короткого времени воздействия импульсом радиации погибает значительное количество раковых клеток. При использовании такой мощности при дистанционной терапии сильно пострадают окружающие ткани. Длительность облучения не должна превышать 20 минут.
Начало процедуры включает обследование органов малого таза с помощью ультразвукового исследования, компьютерной томографии или магнитно-резонансной томографии. Такая подготовка к лучевой терапии обеспечивает врача данными, на основе которых создается трёхмерная модель таза и органов, вычисляется точное местонахождение очага патологического образования. Онколог определяет дозировку облучения и время процедуры.
Под общим наркозом пациенту вводят направляющие, по которым происходит подача импульса в поражённые клетки. Иногда может быть применен эпидуральный наркоз. Все время вживления, проведения облучения и извлечения направляющих составляет 3-4 часа. После проведения процедуры пациента оставляют на сутки в стационаре под наблюдением медицинского персонала.
Выбор метода с низкой лучевой дозой применяется при небольших размерах опухоли и начальных стадиях раковой патологии. В район простаты вживляются имплантаты, содержащие радиоактивный материал. Место вживления и процесс контролируется за счёт визуализированной области малого таза.
Процедура вживления проходит под общим наркозом. Помещение изотопов осуществляется в место нахождения опухоли с помощью специальных игл, которые позволяют быстрее пройти восстановление после оперативного вмешательства, если будет нужна реабилитация.
В стационаре пациент находится не дольше двух дней после процедуры. Затем больного переводят на амбулаторное лечение. На протяжении последующих месяцев запрещены длительные пребывания на солнце, катания на велосипеде. Нельзя сажать на колени детей и животных. Физические нагрузки предусматриваются щадящие.
Питание выстраивается сбалансированным и дробным.
Брахитерапия с низкой дозой
Брахитерапия при раке предстательной железы использует постоянный имплантат для непрерывного низкодозного облучения в течение нескольких недель или месяцев. Врачи часто используют трансректальный ультразвуковой контроль для нужного размещения импланта.
Йод-125 или палладий-103 — радиоактивные вещества, применяемые для низкодозной брахитерапии.
Для того чтобы другие люди не подвергались радиационному воздействию, принимаются специальные меры предосторожности.
Брахитерапию с низкими дозами облучения применяют для лечения рака простаты в начальных стадиях и низким риском рецидива.
Брахитерапия с низкой дозой.
Виды лучевой терапии при раке простаты

Первые эксперименты с радиоактивным излучением проводились в середине двадцатого века. Они показали высокий результат, но при этом выявились определенные минусы. В частности, это серьезное повреждение здоровых клеток, что приводило к целому спектру негативных симптомов.
Современные методики имеют мало общего с прошлыми пробами. Прорывом в терапии рака стало использование узконаправленного излучения. Иными словами, появилась возможность воздействовать исключительно на больной орган, что значительно увеличивает шансы на восстановление.
Стоит знать: все используемые методики лучевого облучения классифицируются на две большие группы – дистанционный способ (внешнее применение радиации) и ионизирующий вариант (влияние на опухоль изнутри). Ни один из применяемых методов не гарантирует 100% исцеление пациента. Для повышения эффективности терапии рекомендуется комбинированное облучение – совмещаются 2 и более способов радиотерапии.
Лучевая терапия аденомы простаты не осуществляется, поскольку гиперплазия предстательной железы является доброкачественным процессом. Целесообразно применять эту методику, если болезнь озлокачествляется, что маловероятно.
Дистанционная терапия подразумевает воздействие на опухоль вне тела пациента. Существует несколько методик проведения:
- Конвенциональный способ применяется чаще всего. В процессе манипуляции аппарату задаются определенные установки, вследствие чего осуществляется воздействие на опухоль под заданным углом;
- 3D-комформное лечение характеризуется предельной точностью влияния на опухолевое новообразование. К преимуществам метода относят малый список побочных эффектов, целенаправленность воздействия, слабое влияние на здоровые ткани. Для манипуляции применяется высокоточное оборудование;
- Метод IMRT расшифровывается как интенсивное лучевое модулированное лечение предстательной железы. Такой вариант способствует снижению негативного воздействия на др. внутренние органы;
- SBRT – стереотаксический способ терапии, предполагающий излучение непосредственно на очаг. Длительность лечебного курса менее семи суток;
- IGRT – облучение с коррекцией изображения. В ходе манипуляции удается получить картинку опухолевого новообразования либо сразу после нее. При этом доза радиации, получаемая нормальными клетками, сводится к нулю.

Отмечается, что внешнее влияние на рак простаты часто приводит к появлению ожога в месте проникновения, ломкости кровеносных сосудов, нередко появляются кровоизлияния.
Брахитерапия либо контактное лечение имеет неоспоримое достоинство – оказывается влияние именно на очаг. Вся манипуляция контролируется посредством аппарата ультразвукового исследования. Радиоактивные зерна вводят специальной иголкой через промежность.
Брахитерапия бывает нескольких типов в зависимости от времени воздействия:
- Продолжительная. В очаг образования вводят стержни, которые обогащены радиоактивным йодом. Выраженность облучения маленькая, но лечебный результат обусловлен постоянным влиянием.
- Временная. Процедура подразумевает введение в простату радиоактивного элемента с большой дозой излучения. Его оставляют внутри тела на малый промежуток времени, затем он извлекается. Это приводит к отмиранию патологических тканей, вследствие чего уменьшается размер простаты.
Дозировка облучения рассчитывается в соответствии с радиологическими схемами, таблицами и установленными международными нормами.
Еще один способ лечения – это протонное воздействие. Терапевтический эффект достигается благодаря влиянию на клеточном уровне. Протоны уничтожают онкологические клетки, при этом дозировка радиации очень маленькая, соответственно, вред для здоровой ткани сводится к минимуму. Вероятность того, что рак простаты после облучения протонным способом вернется, меньше на 10% в сравнении с др. методиками.
Его оставляют внутри тела на малый промежуток времени, затем он извлекается.
Рак простаты: лучше лечить или удалять ее?
Существует несколько возможностей лечения рака простаты с одинаково хорошими прогнозами. Поэтому решение каждого пациента сводится к вопросу: «На какие побочные эффекты я бы вероятнее всего согласился?» О разных методах лечения предстательной железы и их последствиях журналу Quora рассказывает доктор Гари Ларсон, медицинский директор Центра протонной терапии, Оклахома, США:
 – Американская Урологическая Ассоциация периодически проверяет все опубликованные материалы с результатами лечения рака простаты и всегда приходит к одному заключению – в целом нет разницы в вероятности излечения, будь то хирургия или лучевая терапия. Если бы один метод лечения явно превосходил все другие, это упростило бы жизнь. Мы, как врачи, тогда бы выбирали именно его. А так как проценты излечимости одинаковые, мужчинам все же необходимо обдумать все варианты и решить, какое лечение им выбрать (или, скажем так, против какого лечения они бы меньше всего возражали).
– Американская Урологическая Ассоциация периодически проверяет все опубликованные материалы с результатами лечения рака простаты и всегда приходит к одному заключению – в целом нет разницы в вероятности излечения, будь то хирургия или лучевая терапия. Если бы один метод лечения явно превосходил все другие, это упростило бы жизнь. Мы, как врачи, тогда бы выбирали именно его. А так как проценты излечимости одинаковые, мужчинам все же необходимо обдумать все варианты и решить, какое лечение им выбрать (или, скажем так, против какого лечения они бы меньше всего возражали).
Прежде чем продолжить, нужно иметь в виду следующие вещи.
Не все, у кого есть рак простаты, нуждаются в лечении – для многих мужчин будет достаточно активного наблюдения, по крайней мере, в течение короткого периода, а вероятно и всей жизни.
Есть только два метода лечения рака простаты – хирургический и лучевая терапия. Такие вещи как криотерапия, фокусированный ультразвук высокой интенсивности, прогревание микроволновым излучением, лазерная абляция и некоторые другие методы могут быть рекомендованы для рака простаты, повторно появившегося после прохождения основного лечения. Но сами по себе они не могут являться основным лечением.
Андрогенное подавление (гормональная терапия) остановит развитие большинства случаев рака простаты, снизит показатель ПСА практически до нуля и сократит новообразования и метастазы в кости, но его эффект будет только временным – от нескольких месяцев до нескольких лет. Как и методы, указанные выше, это само по себе не радикальное лечение, хотя оно может сочетаться с лучевой терапией для повышения вероятности излечения. Андрогенное подавление имеет набор побочных эффектов, включая усталость, потерю мышечной массы, набор веса, потерю либидо, импотенцию, остеопороз и депрессию.
Урологи любят говорить пациентам: «Если вы пройдете хирургическую операцию, вы всегда сможете после нее получить облучение. Но если вы сначала пролечитесь лучевой терапией, то потом вы не сможете пройти хирургическую операцию». По большей части, это является правдивым утверждением, но данное обобщение упускает некоторые определенные факты.
Во-первых, после лучевой терапии редко возникает необходимость проводить хирургическое вмешательство, так как большинство мужчин, не излечившихся от этой болезни, не имеют рецидивов в простате. Наоборот, при рецидивах после лучевого лечения рака простаты в большинстве случаев обнаруживаются злокачественные опухоли в других органах. Как правило, такие пациенты имели скрытое онкозаболевание помимо простаты, которое нельзя было определить до начала лечения. Скоплениям раковых клеток необходимо разрастись до определенных размеров, чтобы они смогли вызвать повышение показателя ПСА и стали заметными.
Если у пациента после лучевой терапии постоянно отмечается повышенный уровень ПСА, а повторные биопсии железы положительные (между прочим, результаты биопсии являются надежными только спустя два года после лучевой терапии, так как раковые клетки отмирают в течение какого-то времени после лечения), то шансы на рецидив только в железе составляют 50%.
Спасительная в этом случае простатэктомия может быть выполнена после лучевой терапии, хотя это трудная операция из-за интенсивного фиброза вокруг железы и пониженного кровообращения – оба состояния являются результатом перенесенной лучевой терапии. Такие операции лучше всего проводить в крупном урологическом центре, где проводится большое количество подобных вмешательств, вместо того, что доверить эту операцию урологу небольшой клиники. Но даже при высоком мастерстве хирурга существует высокий риск возникновения недержания вследствие простатэктомии, проведенной после лучевой терапии.
Так как риск возникновения рецидива рака только в простате составляет 50 на 50, то и шансы на то, что хирургия приведет к излечению также 50 на 50.
Если первичной была хирургическая операция, то в 20-30% случаев после нее пациент должен пройти лучевую терапию для полного излечения. Послеоперационная лучевая терапия дает 90-процентный шанс ликвидации любого оставшегося рака. Кстати говоря, когда хирурги называют общий процент исцелившихся пациентов, они включают в это число и тех мужчин, которые были вылечены только благодаря послеоперационной лучевой терапии, хотя редко упоминают об этом факте в своих публикациях.
Рак простаты обычно растет медленно. Термин «ранняя стадия» имеет отношение к тому факту, что он все еще локализован в простате или, как минимум, в ближайшей перипростатической ткани. Ранняя стадия также может быть низкого, среднего или высокого риска по шкале Глиссона. Уровень риска определяется врачом после обследования материала биопсии по уровню ПСА и в некоторой степени по количеству положительных образцов биопсии.
Хирургическое лечение и последствия
В целом есть два метода выполнения простатэктомии. Открытая – когда хирург делает разрез от лобковой кости до пупка, вырезает простату и некоторые лимфоузлы, потом присоединяет шейку мочевого пузыря к оставшейся уретре (так как промежуточной уретры простаты уже нет) и оставляет катетер на месте на несколько недель для того, чтобы все зажило. Второй способ – роботизированная простатэктомия. Это практически та же самая операция, но выполняется через маленькие разрезы с использованием дистанционно управляемых роботизированных манипуляторов и стереоскопической визуализации. В опытных руках диссекция является более точной и сроки пребывания пациента в больнице короче. В публикациях сообщается о потенциально возможном снижении побочных эффектов, таких как инфекция и кровотечение, но трудно сказать что-то определенное об осложнениях в долгосрочной перспективе, таких как импотенция и недержание.
Основной побочный эффект, который имеет хирургия и которого нет у лучевой терапии, – это недержание. Большинству мужчин требуется от одного до двух месяцев, чтобы восстановить регуляцию функции мочеиспускания, а около 5% прооперированных никогда не восстанавливают контроль над мочеиспусканием, им приходится использовать памперсы до конца жизни.
Импотенция встречается чаще при хирургии по сравнению с лучевой терапией. Хотя хирургические издания часто сообщают о сохранении потенции на уровне выше 50%, они определяют потенцию как «способность получать эрекцию, достаточную для вагинального проникновения». Поэтому если вы можете заниматься сексом в течение 30 секунд, урологи считают вас способным к половому акту.
Я обследовал первых 150 мужчин, которым я проводил брахитерапию в середине 1990-х и просто задал им такой вопрос: «Вы довольны вашей сексуальной жизнью?» Я оставлял им место на опросном листе для подробного ответа. Более 60% ответили, что они довольны их сексуальной функцией. И ни один из тех, кто сказал, что могут только достичь проникновения, не был доволен.
В нашем Протонном центре всякий раз при последующем приеме мы обследуем каждого мужчину, который прошел у нас лечение, при помощи двух средств оценки качества жизни. Первое из них – это опросный лист «Расширенный индекс рака простаты». А другой – анкета сексуального здоровья для мужчин. В нашей базе данных на данный момент более 2600 пациентов и оценки в баллах у более 70% из них показывают, что они удовлетворены своей сексуальной функцией.
В целом мужчины имеют гораздо лучшую сексуальную функцию и несравненно лучший контроль мочеиспускания (так число случаев недержания практически свелось к нулю – оно почти никогда не встречается при лучевой терапии), если они прошли лечение лучевой терапией, в отличие от хирургии.
Каковы минусы лучевой терапии?
Я коснусь этих моментов, так как они имеют отношение к каждому из различных способов, которыми проводится лучевая терапия.
Для пациентов с низким риском, локализованной болезнью (Глиссон 6 гистология с ПСА менее 10 и менее 4 позитивных образцов биопсии) брахитерапия может использоваться как монотерапия. Пациенты приходят для проведения процедуры разметки, при которой врачи определяют точный контур простаты каждые 5 мм сверху донизу, используя трансректальный ультразвук, а затем в компьютерной программе планирования лечения создают 3-D образ простаты. Рассчитывается оптимальная комбинация радиоактивных зерен, они заранее помещаются в иглы для введения их в железу. В день процедуры пациенту делается общая анестезия и используются от 20 до 40 игл для введения от 60 до 120 зерен в простату при помощи трансректального ультразвукового контроля.
Пациент обычно возвращается домой через несколько часов с катетером, установленным на ночь (так как железа может опухнуть, лучше установить катетер, чем ехать посреди ночи в больницу из-за проблем с мочеиспусканием). Мужчины обычно испытывают довольно серьезные неприятные симптомы, связанные с мочеиспусканием: частота позывов, неспособность терпеть, ночные позывы, сниженный напор струи, – которые проходят через месяц.
Пациенты могут иметь некоторые неприятные ректальные симптомы в течение нескольких недель. Может появиться ректальная язва в течение года или двух после процедуры лечения, если некоторые зерна оказались близко к ректальной стенке. Такая язва всегда заживает со временем, если только гастроэнтеролог не решит провести ее биопсию, заподозрив рак. В этом случае она может никогда не зажить, и пациенту понадобится колостомия.
Если у кого то есть факторы риска, кроме указанных выше, тогда одна только брахитерапия не даст достаточно высоких результатов излечения (вследствие того, что были затронуты перипростатические ткани вне пределов досягаемости радиационных зерен). Понадобится добавить двадцать пять процедур облучения внешней радиации для того, чтобы повысить дозу на перипростатические ткани. Основное преимущество брахитерапии – сокращение времени лечения – будет практически утрачено.
При заболевании от среднего до высокого риска, вероятно, придется выбрать внешнюю лучевую терапию как основной метод лечения, а не брахитерапию плюс сокращенный курс лучевой. Обычно курс лучевой терапии состоит курс из 44 процедур за девять недель.
Побочные эффекты внешней лучевой терапии как основного метода лечения рака простаты
Внешняя лучевая терапия может проводиться высокоэнергетическими рентгеновскими лучами, используя технику лучевой терапии с модулированной интенсивностью, или протонной терапией. Я сравню эти два метода. Кстати, Кибер-нож, томотерапия и другие разнообразные линейные ускорители проводят лечение лучевой терапией с модулированной интенсивностью при помощи рентгеновских лучей (фотонов). Между ними в конечном итоге разницы нет, отличаются только машины, которыми проводят лечение. Возможно, вы также слышали термин лучевая терапия с визуальным контролем, который просто означает, что проводится какое-то сканирование пациента на лечебном столе прямо перед проведением лечения. Это может быть КТ, портальное сканирование, стереоскопические рентгеновские лучи и др. Лучевая терапия с визуальным контролем используется со всеми формами лучевой терапии с модулированной интенсивностью, а также с протонной терапией.
Для обоих методов (протоны или фотоны) планирование лечения начинается с КТ сканирования тонкими слоями, которое интегрировано с высоко детализированной МРТ. КТ необходимо для того, чтобы сообщить компьютеру, планирующему лечение, толщину ткани во всех точках, через которые пройдет луч радиации. МРТ дает лучшую анатомическую картинку для определения контура простаты, семенных желез, мочевого пузыря, прямой кишки и т.д.
После нескольких дней, за которые создаются контуры органов, проводится множество опытов с конфигурацией луча, его модуляцией и т.д., вырабатывается оптимальный план лечения. После этого врач проводит проверку соответствия всем условиям для того, чтобы убедиться, что компьютерные расчеты дадут планируемое распределение дозы в ткани. И, наконец, пациент возвращается для первичного «визуального контроля» и первой из 44 процедур.
Радиолог – онколог встречается с каждым пациентом еженедельно и занимается побочными эффектами, которые могут возникнуть. В ходе лечения лучевой терапией с модулированной интенсивностью фотонами это может быть усталость, иногда до такой степени, что пациентам приходится идти домой и спать пару часов во второй половине дня.
После нескольких недель лечения может появиться ректальное раздражение, которое выражается в симптомах от слабой диареи до боли, кровотечения и постоянного ощущения в необходимости опорожнить кишечник, хотя в стуле может быть ничего, кроме небольшого количества слизи.
Также после нескольких недель лечения могут появиться раздражающие урологические симптомы, такие как частота походов в туалет, неспособность терпеть позывы, медленное опорожнение мочевого пузыря и необходимость несколько раз вставать ночью. Они могут длиться несколько недель после прохождения лечения.
Риски, которые могут возникнуть в будущем, включают развитие рака, вызванного радиацией. Кроме долгосрочного риска появления вторичного рака, большинство побочных эффектов проходят за срок от нескольких месяцев до года после окончания лучевой терапии.
Протонная терапия
При протонной терапии побочные эффекты выглядят иначе. Усталость минимальная или отсутствует вообще. (Я лечил одного заядлого велосипедиста, который проехал на своем велосипеде более тысячи миль за девять недель, во течение которых проходил терапию).
Ректальные симптомы почти не встречаются, так как только очень маленький объем прямой кишки получает радиацию. Урологические раздражающие симптомы могут появиться на такой же срок, как и при лечении рентгеновскими лучами (фотонами), хотя обычно они менее серьезны.
Множественные эпидемиологические исследования показали, что существует только минимальное повышение риска возникновения рака после облучения протонами по сравнению с рентгеновскими лучами. Вероятно из-за меньшего объема ткани, получающего какую-то дозу радиации. Если у мужчин и появляются немногие побочные эффекты, они обычно проходят за несколько недель после окончания облучения протонами.
Каковы сравнительные данные по побочным эффектам протонной терапии против лучевой терапии с модулируемой интенсивностью?
Мы объединили наши данные с различными онкологическими центрами, обследовали приблизительно 1000 пациентов, которые прошли лечение рака простаты протонной терапией, и сравнили их показатели качества жизни с мужчинами из контрольной группы, которые не проходили лечение (потому что у не было рака простаты).
Все мужчины заполняли опросные листы касательно качества их жизни каждые три месяца с начала лечения до, как минимум, одного года после лечения. Результаты показали, что пациенты, которые прошли лечение протонной терапией, имели такие же показатели качества жизни, как и те, у которых даже не было рака простаты.
Рак простаты обычно растет медленно. Не позволяйте никому подгонять вас при принятии решения, которое будет иметь последствия до конца вашей жизни.
Усталость минимальная или отсутствует вообще.
Виды лучевой терапии↑

На сегодняшний день терапия аденокарциномы простаты проводится с помощью таких видов радиотерапии:
- Дистанционная — основана на внешнем воздействии радиоактивного луча на пораженный орган и используется в большинстве случаев. Точное расположение очага патологии определяется с помощью компьютерной и магниторезонансной томографии. При облучении стремятся не повредить структуру здоровых тканей близлежащих органов. Длительность курса составляет семь – восемь недель, а самой процедуры — от десяти минут до получаса. Преимуществами данной методики являются минимальная частота возникновения осложнений, проведение процедуры в амбулаторных условиях и неплохая переносимость больными. Однако при ее проведении сохраняется достаточно высокая вероятность повреждения соседних органов, развитие язвенных поражений кожи, изменение показателей свертываемости крови.
- Брахитерапия — основывается на внутреннем воздействии на злокачественное новообразование. Установив место расположения патологического очага, в него вводится элемент, излучающий радиоволны. Процедура проводится под общим наркозом в условиях стационара. В отличие от традиционной дистанционной радиотерапии, этот метод отличается низким риском проявления осложнений, хорошо переносится больными даже преклонного возраста. Среди основных преимуществ брахитерапии выделяют высокую степень выживаемости больных, короткий реабилитационный период, который составляет около двух дней, эффективность, отсутствие необходимости длительного пребывания в клинике после операции.
- Контактная — метод, при котором облучение проводится в ходе оперативного вмешательства.
- Протонная — специалисты убеждены, что этот метод является наиболее эффективным при аденокарциноме простаты. Протоны, которые разрушительно действуют на раковые клетки, оказывают минимальное негативное влияние на здоровые ткани. Тем не менее, этот способ лечения показан лишь при определенных формах злокачественных новообразований железы.
Контактная радиотерапия представляет собой способ лечения, основанный на комбинации разных методов. Учитывая малую эффективность и высокую частоту осложнений, в наши дни большинство клиник отказались от этой методики.
Нервное напряжение, депрессии.
Последствия лучевой терапии при раке простаты
Облучение при раке простаты 1-2 степени обычно не вызывает серьезных осложнений, так как не требует больших доз излучения, да и может проводиться как монотерапия. При запущенной стадии рака потребует проведение химиотерапии и простатэктомии, соответственно, осложнений может проявиться намного больше.
Самое распространенное осложнение после рака простаты — это нарушения мочеиспускания. Радиоактивное облучение может вызывать раздражение и отек окружающих опухоль здоровых тканей. Как следствие, отекшая простата создает давление на уретру, что приводит к затрудненному отхождению мочи, струя становится слабой. Как следствие, возникают частые позывы к мочеиспусканию.
Если лучевая терапия вызывает раздражение мочевого пузыря, то пациента беспокоит жжение при мочеиспускании. Называется такое состояние лучевой цистит. Чтобы избежать такого осложнения или снизить проявления цистита, в период проведения лечения нужно пить очень много воды. Также рекомендуется обследоваться на предмет инфекций в мочевом пузыре.

Если облучение попадает на кишечник, то возникает диарея и боли в животе. Чтобы избежать такого осложнения, перед процедурой нужно наполнить мочевой пузырь. Он немного сместит кишечник от простаты, чтобы тот не попал в зону облучения. Также полезно будет соблюдать принципы правильного питания, исключить газообразующие продукты из рациона.
Дистанционная лучевая терапия часто провоцирует появление чувства слабости. Симптом может проявляться в разной степени у каждого пациента. В большинстве случаев чувство переутомления связано с нервным перенапряжением, усталостью от постоянных хождений по больницам, но и облучение, при попадании на здоровые ткани, может провоцировать этот симптом.
Еще одно часто осложнение лучевой терапии — импотенция. При монотерапии эректильная дисфункция встречается довольно редко, при воздействии больших доз облучения. Чаще всего импотенция связана с простатэктомией, которая была проведена до воздействия лучами.
Если импотенция возникла после лучевой терапии, есть шанс восстановить мужскую силу при помощи трав и лекарственных средств. Но перед началом лечения нужно обязательно проконсультироваться с врачом, потому что препараты для потенции могут спровоцировать рецидив заболевания.
Симптом может проявляться в разной степени у каждого пациента.
Лучевая терапия при раке простаты

На сегодняшний день злокачественная опухоль простаты у мужчин разной степени тяжести ─ одна из самых распространенных причин летального исхода от онкологии. Среди самых эффективных методов локальной терапии злокачественной опухоли простаты – лучевая терапия.
Применяют данный способ лечения на начальной стадии патологии, а также в случае, когда нет возможности назначить простатэктомию, либо пациент категорически против такого варианта терапии. В более сложных случаях ее проводят в сочетании с лечением гормональными препаратами.
Гамма- или рентгеновские лучи вырабатываются в первом случае.
Брахитерапия или внутреннее воздействие
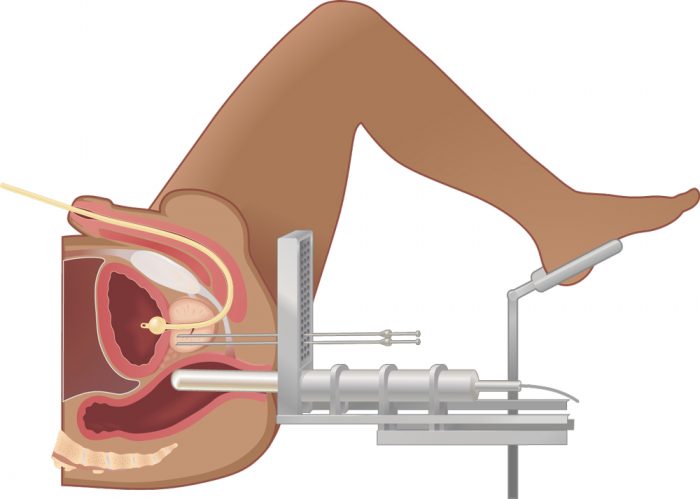
Методика брахитерапии предусматривает контактное воздействие на клетки новообразований. Главной особенностью данного метода является прямое воздействие на непосредственный очаг новообразования. Процедура брахитерапии проводится под контролем трансректального УЗИ. Через промежность в область опухоли вводятся радиоактивные зерна в количестве от 60 до 90 штук. В зависимости от времени введения радиоактивных зерен, процедура воздействия подразделяется на 2 вида:
- Постоянный. Предполагается введение зерен в количестве от 40 до 100 штук. Это зерна йода или палладия, которые с течением времени не представляют опасности для человека. Методика воздействия высоких доз осуществляется непосредственно на саму опухоль, а приближенные ткани страдают в минимальном объеме. Если капсула с зернами через уретру выходит во время мочеиспускания, то необходимо ее взять при помощи пинцета, после чего доставить в клинику, где проводилась терапия.
- Временный. Принцип данной методики заключается во введении в область простаты полой иглы с последующим заполнением полости иридием. По окончанию процедуры происходит извлечение иглы.
После проведения брахитерапии наблюдается продолжительность жизни мужчин более 10 лет. Статистика выживаемости мужчин аналогична, как и при проведении радикальной простатэктомии. Однако такая процедура имеет более негативные последствия, которые проявляются в виде развития импотенции или недержания мочи.
Важно знать! Чем раньше будет начато лечение рака простаты посредством радиологического излучения, тем меньшее количество осложнений он сможет привести.
Исследования показали хорошие результаты выживаемости среди мужчин, которым была проведена лучевая терапия на ранних сроках. Выживаемость намного меньше среди пациентов, у которых рак простаты перешел в стадию обострения.
После проведения брахитерапии наблюдается продолжительность жизни мужчин более 10 лет.
Лучевая терапия рака предстательной железы
Статьи Комментарии
| »» Содержание | Б.П. Матвеев, Б.В. Бухаркин, В.Б. Матвеев |
Глава 8. Лучевая терапия рака предстательной железы
Лучевая терапия является в настоящее время одним из ведущих консервативных специальных методов лечения рака предстательной железы как при локализованном, так и при местнораспространенном процессе.
Дистанционное облучение с применением мегавольтных источников излучения (гамма-установка, линейные ускорители и др.) рекомендуется сейчас при всех стадиях рака предстательной железы (Алиев Б.М., 1983, Свиридова Т.В., 1994, Amin P.P. et al. 1983, Bagschow М.A., 1983 и др.). Оно является альтернативой радикальной простатэктомии в начальной стадии заболевания, в случае невозможности операции в связи с сопутствующими заболеваниями или отказом больного от оперативного лечения. Лучевая терапия с успехом применяется как в случаях локализованного, так и местнораспространенного рака предстательной железы.
При этом в подходах к лучевому лечению у различных авторов имеются существенные различия, касающиеся техники и технологии облучения, объема лучевого воздействия и суммарных очаговых доз.
Противопоказаниями к проведению лучевой терапии считаются: общее тяжелое состояние больного, раковая кахексия, выраженный цистит и пиелонефрит, наличие большого количества остаточной мочи, хроническая почечная недостаточность, азотемия (Голдобенко Г.В., 1997).
Последнее десятилетие ознаменовалось значительным прогрессом в изучении возможностей лучевой терапии рака предстательной железы. Арсенал средств и методов лечения обогатился новыми подходами к лучевому лечению, ряд которых оказался весьма плодотворным. Популярность ее объясняется рядом очевидных преимуществ перед другими известными терапевтическими методами. Лучевая терапия не оказывает пагубного влияния на сердечно-сосудистую и свертывающую системы крови, изменения которых под воздействием гормонотерапии нередко приводят к преждевременным летальным исходам. В последние годы некоторыми исследователями, даже при ранних стадиях заболевания, лучевой терапии отдается предпочтение перед хирургическим лечением (радикальной простатэктомией), так как отдаленные результаты обоих методов приблизительно одинаковы, но облучение не вызывает столь серьезных лечебных последствий, как хирургическое лечение: 0.5-5% – послеоперационной летальности, 95-100% – импотенции, 10-15% – недержание мочи и пр.
Некоторые литературные данные о выживаемости больных раком предстательной железы, леченных лучевым методом представлены в табл. 34.
Таблица 34. Результаты лучевой терапии рака предстательной железы. Выживаемость за 5 и 10 лет.
| Автор | Кол-во больных | T1 | T2 | T3 | T4 | |||
| 5 лет | 10 лет | 5 лет | 10 лет | 5 лет | 10 лет | 5 лет | ||
| Kopper B., 1988 | 112 | 83% | 59% | 83% | 59% | |||
| Reed N., 1988 | 168 | 100% | 77% | 42% | ||||
| Howleu P., 1989 | 126 | 92% | 92% | 72% | ||||
| Maruoka M., 1989 | 129 | 100% | 100% | 75% | ||||
| Zagars G., 1989 | 114 | 84% | 68% | 84% | 68% | 72% | 47% | |
| Cuban D., 1990 | 96 | 61% | 61% | |||||
| Prestone J., 1990 | 191 | 79% | 75,5% | 52,5% | 0% | |||
| Abratt P.P., 1990 | 93 | 83% | 83% | 83% | ||||
| Jrumiyama K., 1990 | 33 | 100% | 100% | 65% | 50% | |||
| Lioyd-Da-Vies, 1990 | 209 | 67% | 32% | 67% | 32% | 67% | ||
| Fuse H., 1991 | 41 | 86% | 66% | 47% | ||||
| Kuten A., 1992 | 116 | 84% | 78% | 63% | ||||
| Kaprowsky C., 1992 | 176 | 95% | 80% | |||||
Эффективность радиотерапии больных раком предстательной железы во многом зависит от качества планирования облучения. Планированию лучевой терапии и ее клинико-дозиметрическому обоснованию обычно предшествует топометрическая подготовка больных. С этой целью широко применяются такие виды рентгенологического исследования как компьютерная томография, магнитно-ядерный резонанс и др.
В последние годы для оптимизации лучевой терапии широко применяются компьютерные программы и специальные устройства, так называемое конформальное (conformal) облучение, которые позволяют с учетом гетерогенности тканей и кривизны облучаемого участка в трех проекциях выбрать наиболее рациональные условия лучевого воздействия. В качестве критериев при этом выбрана лучевая нагрузка на наружные подвздошные и обтурационные лимфатические узлы, кожу передней и задней поверхности тела больного, тазобедренный сустав. Характер распределения доз определяют во фронтальной, сагиттальной и горизонтальной плоскостях облучаемого участка тела пациента. При оценке полученных данных исходят из того, что первичная опухоль и зоны регионарного метастазирования должны облучаться равномерно с допустимым градиентом дозы 90-100%, а лучевая нагрузка на тазобедренный сустав, заднюю стенку прямой кишки и на уровне кожных покровов не должна превышать их толерантность.
На основании полученной топометрической информации проводят тщательный анализ распределения доз при различных вариантах дистанционной гамма-терапии. Общим выводом из этих исследований явилось признание рациональности использования при локализованных формах рака предстательной железы подвижных методик дистанционной гамма-терапии, т.е. облучение только первичной опухоли; при распространенности опухоли на регионарные лимфатические узлы – сочетание вариантов подвижного и статического 4-х польного перекрестного облучения с соотношением доз с передних и задних полей 2:1. Показано, что при использовании этих вариантов облучения, лучевая нагрузка на заднюю стенку прямой кишки снижается почти на 20%, на кожные покровы ягодичной области – на 20-30% по сравнению с гамма-терапией с соотношением доз 1:1 и с однозонным подвижным облучением первичной опухоли с углом качания 240° или же двухзонным облучением с углом качания 180°. Лучевая нагрузка на уровне кожных покровов лобковой зоны с соотношением доз 2:1 находится на том же уровне, что и при старых вариантах гамма-терапии с соотношением доз 1:1, составляя 60% от величины очаговой дозы облучения.
На основе комплексного обследования, тщательной дозиметрической подготовки, а также в зависимости от распространенности опухолевого процecca, выделяют следующие варианты дистанционной лучевой терапии рака предстательной железы.
1. Облучение только первичной опухоли. В зависимости от размеров новообразования, распространения его на соседние органы и тканевые структуры, применяется одно- или двухзонная подвижная дистанционная гамма-терапия с требуемыми разведениями осей ротации, углами вращения 90°-120°. При инфильтрации одной или двух боковых стенок таза используется методика двухзонной ротации с углами качания 60°-90°. Размер поля на оси ротации, в зависимости от параметров опухоли, колеблется от 4 х 8 до 9 х 11 см. При этом в зону облучения включается первичная опухоль, шейка мочевого пузыря, передняя стенка прямой кишки с постепенным снижением поглощенных доз в направлении задней ее стенки, а также к тазобедренному суставу, до уровня ниже их толерантности. В зависимости от величины и конфигурации предстательной железы, изменяются размеры полей облучения, сектор качания и расстояние между осями качания в условиях двухзонного подвижного облучения. Если одна из долей железы увеличена, а другая имеет небольшие размеры, необходимо со стороны большего поражения железы увеличить только одно поле облучения. Разовая доза 1,8-2 Гр, суммарная – 65-70 Гр. Перерыв на дозе 30-40 Гр и продолжение облучения через 2-3 недели. Показания: ранние стадии заболевания – T1-2N0M0.
2. Облучение первичной опухоли и регионарных лимфатических узлов таза. Дистанционная гамма-терапия проводится с 4-х статических полей под углом 45° – два поля спереди, два сзади, с соотношением лучевой нагрузки с передних и задних полей 2:1. Для охвата опухоли и путей регионарного метастазирования 90-100% изодозой нижний край поля облучения располагается на уровне ануса, верхний – на уровне первого крестцового позвонка – места перехода внутренней и наружной цепочек лимфатических коллекторов в общую. Наружная граница поля проходит по линии, пересекающей внутренний край вертлужной впадины. После суммарной очаговой дозы 45 Гр поля уменьшаются в размерах и облучение проводится только на первичную опухоль одно- или двухзонной секторной ротацией до общей дозы 65-70 Гр. Углы качания варьируют при однозонной ротации от 90° до 120°, при двухзонной – от 60° до 90°. Облучение осуществляется в дозе 20-25 Гр (РОД 1,8-2 Гр) после перерыва в 2-3 недели. Показания: больные раком предстательной железы в стадии заболевания – T1-2N1-3M0, T3-4N0-x М0. При Т1-2NxM0 – суммарная доза на регионарные лимфатические узлы может быть ограничена дозой 45 Гр, на предстательную железу доза доводится до 65-70 Гр. При наличии метастатического поражения лимфатических узлов, общая суммарная доза на них доводится до 50-60 Гр.
3. Облучение первичной опухоли и лимфатических узлов таза с включением парааортальной и общей подвздошной групп лимфатических коллекторов. Лучевая терапия при этом проводится на фоне приема гормональных препаратов. Сначала облучению подвергается первичная опухоль и регионарные лимфатические узлы до общей очаговой дозы 40-45 Гр. На втором этапе расщепленного курса, после перерыва 2-3 недели, подключается облучение общих подвздошных и парааортальных лимфатических узлов с двух-фигурных полей, имеющих форму перевернутой буквы “U” с экранированием спинного мозга и почек до суммарной очаговой дозы 40 Гр. Затем продолжается облучение первичной опухоли суженными полями подвижным методом до общей очаговой дозы 65-70 Гр при значении разовой дозы 1.8-2 Гр. Показания: распространение опухоли на юкстарегионарные лимфатические узлы – Т1-4N2-3M0.
Больший объем тканей облучают на первом этапе лучевого лечения. Разовую очаговую дозу 1.8-2 Гр подводят ежедневно 5 раз в неделю. Суммарная очаговая доза достигает 45-50 Гр. Затем проводят облучение только предстательной железы и прилежащих тканей. Большинство авторов полагают, что рациональная суммарная очаговая доза, рассчитанная в центре железы должна составлять при Т0-1 – 60 Гр, при Т2 – 60-65 Гр, при Т3 – 65-70 Гр, при Т4 – более 70 Гр. При этом доза на расстоянии 4 см от центра железы должна достигать при Т0-2 -6 0 Гр, при Т3 – 65-70 Гр и при Т4 – более 70 Гр (Hanks G. et al., 1985).
При использовании высокоэнергетического излучения ускорителей (> 10 Мэв) облучение первичной опухоли и лимфатических узлов таза рекомендуется проводить с двух противолежащих полей (переднего и заднего), либо с четырех полей (переднего, заднего и двух боковых). Используя фотоны ниже 18 Мэв, передне-задними полями можно подвести дозу до 45 Гр и дополнительную дозу путем подключения боковых полей (Голдобенко Г.В., 1997).
Последние литературные данные свидетельствуют о серьезных достижениях лучевого метода лечения. Так группа RTOG привела отдаленные результаты лучевого лечения крупнейших лечебных учреждений, занимающихся этой проблемой. Они представлены в табл. 35.
Таблица 35. Отдаленные результаты лучевой терапии рака предстательной железы в % (RTOOG, Dearnaley D. ,1998).
| Стадия | Кол-во больных | Локальный рецидив | Безрецидивная выживаемость | Общая выживаемость | ||||||
| 5 лет | 10 лет | 15 лет | 5 лет | 10 лет | 15 лет | 5 лет | 10 лет | 15 лет | ||
| Т1 | 583 | 3-6 | 4-8 | 17 | 84-85 | 52-68 | 39 | 83-95 | 52-76 | 41-46 |
| Т2 | 1117 | 12-14 | 17-29 | 32-35 | 66-90 | 27-85 | 15-42 | 74-78 | 43-70 | 22-36 |
| Т3 | 2292 | 12-26 | 19-31 | 25-56 | 32-60 | 14-16 | 17-40 | 56-72 | 32-42 | 23-27 |
Bagshaw M.A. et al.,1994, сообщили отдаленные результаты дистанционной лучевой терапии у 1245 пациентов со стадией Т1-2 при сроке наблюдения 31.5 года (медиана – 7.8 лет). Общая 15-летняя выживаемость больных не имевших метастазов в лимфатические узлы составила 53%.
Hanks et al.,1997, приводят результаты 3-летней (биохимической) безрецидивной выживаемости 233 пациентов с клинической стадией Т3 в зависимости от уровня ПСА перед началом лечения.(табл. 36)
Таблица 36. 3-летняя безрецидивная выживаемость больных раком предстательной железы в стадии Т3 в зависимости от уровня ПСА перед лечением и дозы радиации (Hanks et аl .,1997).
| Доза | ПСА 10-19,9 | ПСА > 20 |
| 70 Гр | 69% | 36% |
| 75 Гр | 80% | 46% |
| 80 Гр | 89% | 57% |
Мнения относительно дополнительных лечебных мероприятий на фоне облучения расходятся. Так И.А. Клименко и соавт.(1976), М.С. Старичков и соавт. (1980), С.И. Ткачев (1982) рекомендуют облучение на фоне гормонотерапии больным в стадии T3-4, Green et al. (1975) считают эстрогенотерапию благоприятной при прогрессирующих опухолях перед началом лучевого лечения с целью уменьшения объема мишени предстоящего облучения. Некоторые авторы (Klosterhalfen et al., 1982) в стадии Т3 дополняют лучевое лечение гормонами и кастрацией. При наличии симптомов инфравезикальной обструкции с хронической задержкой мочи на первом этапе проводят трансуретральную резекцию предстательной железы (ТУР) или операции отведения мочи с последующей (на 2 этапе) лучевой терапией.
В последние годы определенную новизну представляют попытки разработать дифференцированные показания к лучевой терапии в зависимости от степени злокачественности опухоли. С точки зрения Алиева Б.М. (1985) лучевое лечение всех недифференцированных вариантов рака предстательной железы должно вестись на фоне гормонотерапии независимо от стадии. Свиридова Т.В. с соавт. (1984, 1994) расширяют показания к комплексному гормонально-химиолучевому лечению, полагая, что оно должно применяться во всех стадиях низкодифференцированного и анапластического рака, а лучевая терапия в самостоятельном варианте должна использоваться при стадиях Т1-3 высоко- и умеренно-дифференцированного рака без поражения регионарных лимфоузлов.
Данные последних лет свидетельствуют о преимуществе комбинированного гормоно-лучевого лечения у больных раком предстательной железы с неблагоприятным прогнозом. Так в исследовании EORTC, включающем 401 пациента раком предстательной железы в стадии Т1-2 G 3 и стадиях Т3 и Т4 без отдаленных метастазов показано улучшение результатов лечения при применении адъювантной терапии аналогами LНRH, в частности, золадексом (Воllа M. et аl., 1998). Эти данные представлены в табл. 37.
Таблица 37. 5-летние результаты адъювантной гормонотерапии в комбинации с лучевой терапией больных раком предстательной железы в % (EORTC, 1998).
, 1991 41 86 66 47 Kuten A.
Брахитерапия
Брахитерапия — контактная форма лучевой терапии, применяемая на ранних стадиях рака предстательной железы. Принцип действия заключается в возможности подведения источника излучения непосредственно к пораженным клеткам опухоли при помощи подкожной инъекции. В результате новообразование получает максимальные дозы облучения. Риск повреждения здоровых тканей в прямой кишке и мочевом пузыре минимизируется.
В зависимости от состояния больного, врач назначает брахитерапию с высокой (HDR) или низкой (LDR) концентрацией облучения. Первый вариант предполагает использование радиоактивного материала в течение короткого промежутка времени. Низкодозная брахитерапия подразумевает введение в простату крошечных имплантатов с низкой дозой облучения, которые остаются там на три месяца.
В зависимости от состояния больного, врач назначает брахитерапию с высокой HDR или низкой LDR концентрацией облучения.
Системная лучевая терапия
Под системной лучевой терапией понимается дистанционное облучение всего организма. Такой метод отличается большим количеством побочных эффектов, так как затрагивает и здоровые ткани, однако его целесообразно применять при распространении метастазов, совместно с другими способами лечения рака.
Использование этого изотопа отличается двумя преимуществами высокая мощность излучения и сравнительно короткий период распада меньше 12 дней.
Диагностика рака простаты
Сегодня применяются различные средства диагностики, позволяющие выявить рак и оценить его распространение. Каждый из методов важен и имеет свое место в диагностическом процессе.
Главное скрининговое исследование, которое характеризуется высокой чувствительностью.
Лучевая терапия при раке простаты
Лучевая терапия с середины 20 века стала рассматриваться в качестве альтернативы классическому хирургическому методу и активно изучаться. Ведь при большинстве операций не удается избежать повреждений сосудистых и нервных структур, находящихся рядом с предстательной железой. Это приводит к осложнениям: недержанию мочи (после операции от этого страдает каждый 5-й пациент) и импотенции.
Облучение опухоли простаты способствует достижению длительного контроля над ней и даже излечению от заболевания, помогает избежать неприятных побочных эффектов.
Лучевая терапия с середины 20 века стала рассматриваться в качестве альтернативы классическому хирургическому методу и активно изучаться.
Тактика в зависимости от стадии
Выбор лечения при РПЖ зависит от стадии заболевания, состояния пациента, оснащенности медучреждения. Значение имеет информированность и настроенность самого больного.

- При локализованной форме – радикальное удаление или полная регрессия опухоли.
- Местнораспространенный рак – стабилизация роста, частичная или полная регрессия.
- При метастатическом РПЖ – увеличение продолжительности жизни, улучшение общего состояния.
Двусторонняя орхиэктомия.





