Эпидемиология гемолитико-уремического синдрома
Более чем у 85% детей с гемолитико-уремическим синдромом заболевание развивается на фоне инфекции, вызванной штаммом Escherichia coli О157:Н7. Эта инфекция чаще возникает в возрасте от 9 мес до 4 лет. В виде спорадических случаев и эпидемий она встречается повсеместно; по непонятным причинам у американских негров она редка.
В Северной Америке заболеваемость повышается летом и осенью. Резервуаром инфекции служит крупный рогатый скот, в США носительство штамма Escherichia coli О157:Н7 выявляют примерно у 1% скота. Escherichia coli погибает под действием высокой температуры, поэтому причиной заражения часто служит недостаточная кулинарная обработка говядины.
Иногда возбудителя обнаруживают в воде естественных водоемов и плавательных бассейнов. Источником заражения могут стать некипяченое коровье молоко, а также загрязненные навозом овощи и фрукты и приготовленные из них соки. Реже встречается передача от больного человека здоровому. Риск гемолитико-уремического синдрома у детей до 15 лет с геморрагическим колитом, вызванным штаммом Escherichia coli 0157:Н7, составляет 8—10%.
Лучший способ профилактики инфекции — тщательная кулинарная обработка при приготовлении блюд из говядины, а также мытье фруктов и овощей. Регулярное мытье рук предотвращает контактный путь заражения. Еще эффективнее могли бы защитить от инфекции обработка мяса ионизирующим излучением и вакцинация, но пока эти методы недоступны.
В настоящее время испытывается препарат под названием Synsorb-Pk, представляющий собой синтетический рецептор веротоксинов на инертном носителе — диатомите. Этот рецептор способен избирательно связывать веротоксины. Применение Synsorb-Pky детей с геморрагическим колитом, вызванным штаммом 0157:Н7, возможно, снизит заболеваемость гемолитико-уремическим синдромом.
Применение Synsorb-Pky детей с геморрагическим колитом, вызванным штаммом 0157 Н7, возможно, снизит заболеваемость гемолитико-уремическим синдромом.
Симптомы гемолитико-уремического синдрома
В клинической картине гемолитико-уремического синдрома различают продромальный период, разгар заболевания и восстановительный период. Продолжительность продромального периода составляет от 2 до 7 суток. Для него характерно появление признаков поражения ЖКТ или дыхательных путей.
Гемолитико-уремический синдром на фоне ОКИ, вызванной энтеропатогенной Е. coli, имеет ярко выраженную симптоматику. Развиваются симптомы гастроэнтерита или колита (часто кровавая диарея), тошнота, рвота, абдоминальные боли, лихорадка. Постепенно общее состояния ребенка ухудшается, повышенная возбудимость сменяется вялостью.
В период разгара гемолитико-уремического синдрома превалируют проявления гемолитической анемии, тромбоцитопении и ОПН: бледность и иктеричность кожного покрова, склер и слизистых оболочек; пастозность век, голеней; кожный геморрагический синдром в виде петехий или экхимозов, иногда – носовые кровотечения, в тяжелых случаях – снижение диуреза (олигурия или анурия). Тяжесть и продолжительность дизурии зависит от степени и глубины повреждения почек.
Гемолитико-уремический синдром может проявляться полиорганной патологией: поражением ЦНС, печени, поджелудочной железы, сердца, артериальной гипертензией. В 50% случаев гемолитико-уремического синдрома наблюдаются неврологические нарушения: подергивания мышц, гиперрефлексия, децеребрационная ригидность, гемипарезы, судороги, ступор, кома (особенно выраженные у детей первых лет жизни). Выявляются гепатоспленомегалия, кардиомиопатия, тахикардия, аритмия.
Продолжительность гемолитико-уремического синдрома обычно составляет 1-2 недели, затем наступает стабилизация и в 70% случаев – постепенное восстановление нарушенных функций: улучшение выделения мочи, повышение уровня тромбоцитов, нормализация уровня гемоглобина. При тяжелом течении наступает либо летальный исход вследствие экстраренальных поражений, либо формирование ХПН.
В период разгара гемолитико-уремического синдрома превалируют проявления гемолитической анемии, тромбоцитопении и ОПН бледность и иктеричность кожного покрова, склер и слизистых оболочек; пастозность век, голеней; кожный геморрагический синдром в виде петехий или экхимозов, иногда – носовые кровотечения, в тяжелых случаях – снижение диуреза олигурия или анурия.
Патогенез
Бактериальные токсины поражают клетки кишечника, что приводит к развитию геморрагического колита.
Осложнения
Shigella dysenteriae тип 1, продуцирующая шигатоксин, является основной причиной ГУС в эндемических регионах, таких как Бангладеш или Африка. Этот тип ГУС протекает тяжелее, чем STEC-ГУС. В 20% случаев отмечается бактериемия, часто с развитием септического шока и внурисосудистой коагуляции. Смертность колеблется в пределах 20 – 40%. У 40 % развивается ХПН, которая в течение нескольких лет достигает терминальной стадии. Раннее назначение антибиотиков (цефалоспорины 3 поколения или хинолоны) снижают риск развития ГУС у детей, инфицированных Shigella dysenteriae тип 1 [2].
Введение плазмы и не отмытых эритроцитов противопоказано, поскольку они содержат анти-Т IgM антитела, которые могут спровоцировать рецидив ГУС. Отдельные работы свидетельствуют об эффективности заменного переливания плазмы (ЗПП) с последующим замещением альбумином.
Большинство больных при возврате аГУС теряют почки менее, чем через 1 год.
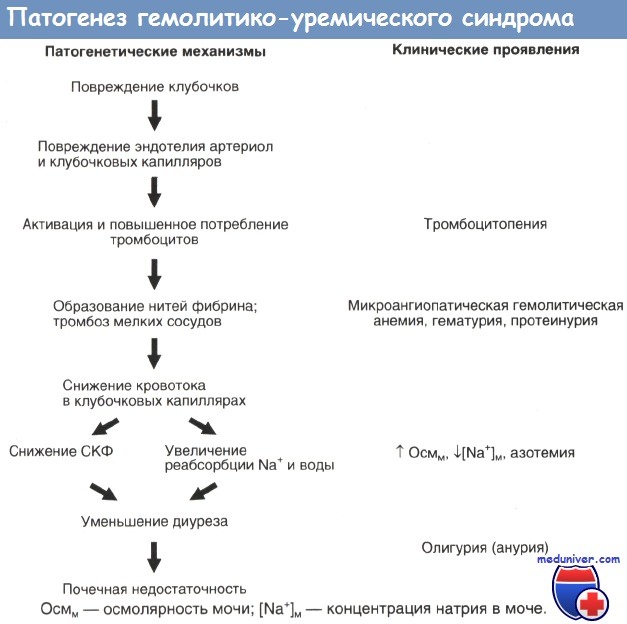
Патогенез гемолитико-уремического синдрома

Раньше гемолитико-уремический синдром был редким, а теперь стал частым заболеванием, с драматическим течением. Характеризуется тяжелой гемолитической анемией, различными изменениями в эритроцитах, тромбоцитопенией и острой почечной недостаточностью. Встречается главным образом у грудных детей, но иногда и в периоде созревания. Иногда носит эпидемический характер.
Причина гемолитико-уремического синдрова неизвестна. Некоторые черты его напоминают тромботическо-тромбоцитопеническую пурпуру. Данные некоторых исследований, особенно гистологических, напоминают реакции т. н. феномена Шварцмана. Однако, тест Кумбса отрицательный, уровень комплемента не снижен, а в почках не были обнаружены иммуноглобулины. Высокая частота наблюдений в определенных областях заставляет подозревать эпидемическую зависимость и вероятность вирусного происхождения. Однако выявить специфический вирус не удалось.
Патогенез основного механизма не выяснен. Преобладает мнение, что гемолитико-уремический синдром является скорее следствием множественной внутрисосудистой коагуляции, чем результатом иммунологического процесса, в результате реакции антиген-антитело. В мелких сосудах почек образуются тромбы, которые причиняют некроз отдельных клубочков и больших участков коры почек. В месте расположения тромбов имеется нарушение сосудистой стенки. До настоящего времени не удалось выяснить, что является первичным — развитие тромбов или нарушение целостности стенки сосудов. Поврежденные эритроциты устраняются из циркуляции. При образовании тромбов усиленно потребляются тромбоциты и коагуляционные факторы. Поэтому количество тромбоцитов падает, может снижаться и концентрация других факторов. В результате этой коагулопатии потребления увеличивается кровоточивость.
Обычно имеется продромальная стадия, которая продолжается 3-10 дней и характеризуется поносом, рвотой, а иногда инфекцией верхник дыхательных путей. Собственное заболевание начинается с бледности, общей слабости, олигурии, а часто гастроэнтеритом. Быстро развивается гемолитическая анемия, концентрация гемоглобина быстро падает, повышается количество ретикулоцитов, растет уровень билирубина и появляется желтушное окрашивание слизистых оболочек и кожи. Количество мочи уменьшается, вплоть до анурии. Может появиться бред, потеря сознания и судороги. Может быть лихорадка. В анализах крови обнаруживают в разной степени поврежденные эритроциты и их фрагменты, типичные формы — треугольные, шлемовидные, языкообразные и листовидные. Количество тромбоцитов обычно уменьшено, однако у некоторых больных может оставаться нормальным. Кровотечение, особенно в кишечном тракте, может быть тяжелым. Склонность к образованию петехий в коже и слизистых бывает только при значительном снижении тромбоцитов. Редко наблюдается кровоизлияние в центральной нервной системе. Количество лейкоцитов бывает умеренно повышенным.
В моче обнаруживают белок, цилиндры, часто кровь, а иногда гемоглобин. Острая почечная недостаточность сопровождается соответствующими сдвигами в сыворотке крови.
Повышение артериального давления может быть значительным и вызывать нарушения центральной нервной системы и функции сердца. Недостаточность кровообращения может быть вызвана передозировкой жидкости, уремией, гипертензией или электролитными нарушениями.
Нарушения в центральной нервной системе могут быть связаны с гипертензией, электролитными сдвигами, дилюционной гипонатриемией, уремическим состоянием, быстрым снижением эритроцитов — ниже 2000000, а иногда, образованием микротромбов, или кровоизлиянием в центральной нервной системе. Предполагается и возможность действия нейротропного вируса, который одновременно является ренотропным.
Острая почечная недостаточность с тяжелой олигурией может продолжаться несколько дней и недель, может заканчиваться смертью или восстановлением диуреза. Функция почек может полностью нормализоваться, однако некоторые отклонения ее могут продолжаться в течение различного периода времени. Иногда функция почек не восстанавливается и случай кончается хронической почечной недостаточностью. Неподдающаяся лечению гипертензия является грозным осложнением, которое может появляться даже несмотря на возобновление диуреза.
Гемолиз после возобновления диуреза может продолжаться в течение как короткого, так и длительного периода времени. Уменьшение количества тромбоцитов может продолжаться очень долго, оно может еще более усугубляться в связи с падением числа эритроцитов или независимо от них. В единичных случаях мы наблюдали повторение острых эпизодов гемолиза с повышением билирубина в плазме и глубоким падением количества эритроцитов.
Смерть в острой стадии может наступать в результате почечной недостаточности, недостаточности сердца, анемии, нарушений центральной нервной системы, сепсиса, отека легких, гипертензии, гиперкалиемии или уремии.
Лабораторные анализы. Картина крови показывает малое количество эритроцитов, низкое содержание гемоглобина (ниже 10 г%), разрушенные и фрагментированные эритроциты, увеличение количества ретикулоцитов (более 2 %, но и более 40 %), тромбоцитопению, а часто лейкоцитоз со сдвигом влево, в сыворотке крови увеличен уровень билирубина, преимущественно непрямого. Тест Кумбса отрицательный. Иногда в плазме находят гемоглобин, редко в моче.
Гаптоглобин низкий или отсутствует. Антинуклеарный фактор негативный. Бета-1С глобулин и общий комплемент являются нормальными. Уровни коагуляционных факторов скорее повышены или находятся у верхних границ нормы, чем понижены. Антитела против тромбоцитов отсутствуют. Потребление протромбина ненормально, даже в то время, когда количество тромбоцитов уже нормальное. Продукты распада фибрина повышены, что некоторыми авторами считается доказательством внутрисосудистой коагуляции. Однако, это явление не было подтверждено большинством авторов. При острой почечной недостаточности в сыворотке увеличен уровень креатинина, мочевины, мочевой кислоты, анорганического Р и К. Соответственно поражению почек повышаются лактикодегидрогеназы. Поражение печени не является типичным, однако было отмечено значительное повышение трансаминаз SGOT и SGPT. В окрашенных препаратах пунктата мозгового слоя метакариоциты были нормальными.
В моче обнаруживают белок, кровь, иногда гемоглобин. До превышения порога гемоглобин в моче может отсутствовать.
Дифференциальной диагностикой нужно исключить тромботическую пурпуру. При этом тромбируются артериолы различных органов и в типичных случаях дифференциальный диагноз не представляет трудностей. Однако, если при тромботической тромбопенической пурпуре поражаются главным образом почки, диагностика гемолитико-уремического синдрома затруднена. Поэтому некоторые случаи тромботической тромбопенической пурпуры включаются в группу гемолитико-уремического синдрома, что извращает конечные результаты лечения, так как тромботическая тромбопеническая пурпура чаще всего кончается летально.
Патологоанатомические исследования выявляют иногда двухсторонний кортикальный некроз, чаще сморщенные почки с почечными геморрагиями. Гистология выявляет фибриновые микротромбы в капиллярах клубочков с васкулярной эндотелиальной пролиферацией, так что картина напоминает очаговый гломерулонефрит. Только в единичных случаях обнаруживаются микротромбы в других органах, например в кишечнике, поджелудочной железе, мозге, коже, миокарде и в надпочечниках. При электронной микроскопии находят расширение центральной цитоплазмы эндотелиальных клеток, депозиты грубозернистого и фибриллярного насыщенного материала, который имеет характер фибрина на эндотелиальной поверхности базальной мембраны и слияния педицел у депозитов. Биопсия через несколько месяцев выявляет ишемические и некротические клубочки, местами эктазию клубочковых капилляров, внутрикапиллярные тромбы, а позже гиалинизацию клубочков, очаговые инфаркты, атрофию канальцев и фиброз.
Специфического лечения нет. Симптоматически следует лечить острую почечную недостаточность, анемию, поддерживать водно-электролитное равновесие, ликвидировать гипертензию, а при необходимости и судороги. Диализ, прежде всего перитонеальный диализ, применяется при острой почечной недостаточности по обычным показаниям. Для профилактики у детей внутрисосудистой коагуляции был предложен и практически апробирован при лечении гемолитико-уремичекого синдрома гепарин. Для растворения образовавшихся уже тромбов применялась также стрептокиназа. В современной литературе преобладает мнение, что наилучшие результаты лечения у детей дает своевременно проведенный перитонеальный диализ без гепаринизации и без применения фибринолитических средств.
Трансфузия эритромассы по 2,5 мл/кг показана при значительном снижении гемоглобина в крови. При угрозе развития гипертензии и увеличения внеклеточной жидкости рекомендуется перед введением эритромассы отсосать соответствующее количество крови больного.
Прогноз при острой анурической фазе после внедрения перитонеального диализа и применения других лечебных мероприятий улучшился. Смертность снизилась с 50 % до 15 %. Почти у половины больных, которые пережили анурическую фазу, можно ожидать восстановления функции почек, несмотря на то, что остаточные явления, в виде наличия белка в моче и нарушения концентрационной способности, могут продолжаться еще долго, даже более одного года. Почти у одной трети выживших больных имеет место клиническая или биопсическая картина, напоминающая прогрессирующий гломерулонефрит или злокачественный нефросклероз. У некоторых больных развивается гипертензия. Таким образом, гемолитико-уремический синдром стал одной из главных причин развития хронической почечной недостаточности.
Тромботическая тромбоцитопеническая пурпура является синдромом, который может напоминать гемолитико-уремический синдром и характеризуется гемолитической анемией, пурпурой, тошнотами, рвотами, мышечными болями и нарушениями нервной системы. Количество тромбоцитов понижено, красные кровяные тельца имеют самую разнообразную морфологическую форму. На вскрытии, в различных органах, не только в почках, находят закупорку артериол эозинофильными массами. Данные анализа мочи говорят о наличии крови, белка и цилиндров. Уровень мочевины в крови повышен. Все это свидетельствует о поражении почек. Заболевание может протекать хронически или остро.
Проводятся те же мероприятия, что при гемолитико-уремическом синдроме. Прогноз неблагоприятный.
Есть основания предполагать, что гемолитико-уремический синдром является только определенным вариантом тромбоцитопенической пурпуры, при котором преимущественно поражаются почки, а остальные органы поражены лишь в небольшой степени. Различия могут быть обусловлены возрастом, так как гемолитико-уремический синдром поражает главным образом грудных детей и детей младшего возраста.
Прогноз при острой анурической фазе после внедрения перитонеального диализа и применения других лечебных мероприятий улучшился.
Гемолитико-уремический синдром

Гемолитико-уремический синдром (ГУС, болезнь Гассера) – наиболее распространенная разновидность тромботической микроангиопатии, состояния, характеризующегося множественным тромбообразованием с закупоркой гиалиновыми тромбами сосудов мелкого калибра. Это приводит, во-первых, к уменьшению содержания в крови тромбоцитов – тромбоцитопении, а во-вторых, способствует возникновению ишемии в головном мозге, печени, почках, сердце и других органах.
Непосредственно гемолитико-уремический синдром известен в литературе с 1955 г., благодаря трудам C. Gasser и соавторов. Результатом их наблюдений стало описание болезней с характерным сочетанием симптомов:
- острая почечная недостаточность (ОПН);
- гемолитическая анемия;
- тромбоцитопения.
Считается, что гемолитико-уремический синдром – болезнь, поражающая чаще всего детей грудного и младшего возраста. Тем не менее, может она встречаться и у школьников, и даже у взрослых. Несмотря на то, что взрослые болеют относительно редко – чаще регистрируются случаи заболевания у женщин в периоде после родов, – течение болезни у них не только более тяжелое, но и приобретает в большинстве случаев хронический или рецидивирующий характер. Более чем у 50% больных синдром переходит хроническую почечную недостаточность (ХПН), остаются непоправимые нарушения в функциях центральной нервной системы. В период разгара заболевания число смертельных исходов достигает 25%. На сегодняшний день гемолитико-уремический синдром – основная причина ОПН у детей младше 5 лет, при этом лечение типичной формы данного состояния дает вполне успешные результаты, а вот последствия атипичной формы по-прежнему весьма неблагоприятны.
Это состояние обозначается как типичная форма гемолитико-уремического синдрома Stx-HUS Д.
Патогенез гемолитико-уремического синдрома

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Многообразие факторов, вызывающих развитие гемолитико-уремического синдрома с однотипными клиническими проявлениями, свидетельствуют об общности механизма их действия. Показано, что основным свойством агента, вызывающего гемолитико-уремический синдром, является его способность повреждать эндотелиальные клетки (ЭК). Специальные ультраструктурные исследования выявляют у больных гемолитико-уремическим синдромом отек эндотелиальных клеток, отслоение их от базальной мембраны и уменьшение просвета капилляров. Непосредственное разрушающее действие на эндотелиальные клетки оказывают микробы, бактериальные токсины, вирусы, комплексы антиген-антитело. Повреждение ЭК на фоне кишечной инфекции обусловлено действием веротоксина Е. Coli и шигатоксина S. Dysenteriae, которые являются как цитотоксинами, так и нейротоксннами. В последнее время особую роль отводят Е. Coli 0157 : Н7, имеющей различные веротоксины. В разрушении ЭК участвуют выделяемые из полиморфно-ядерных лейкоцитов (ПМЯЛ) протеолитические ферменты и свободные метаболиты окисления. Усиливают патологический процесс в ЭК и медиаторы воспаления – интерлейкин-1 (ИЛ-1) и фактов некроза опухоли (ФНО), которые продуцируются ПМЯЛ под влиянием бактерий и выделяемых из них эндотоксинов. ПМЯЛ активируются при гемолитико-уремическом синдроме интерлейкином-8. Еще одним механизмом повреждения ЭК является активация системы комплемента.
Выделяют два пусковых момента, предшествующих развитию гемолитико-уремического синдрома. При диарейных формах гемолитико-уремического синдрома наблюдаются активация факторов свертывания крови и развитие диссеминированного внутрисосудистого свертывания крови (ДВС), что обусловливает характерную клинико-морфологическую картину заболевания. При вариантах гемолитико-уремического синдрома, не связанных с кишечными инфекциями, чаще всего обнаруживают внутрисосудистую активацию тромбоцитов на протяжении длительного срока наблюдения, нередко без каких-либо признаков ДВС. Однако в настоящее время доказано, что главным пусковым моментом развития гемолитико-уремического синдрома является повреждение эндотелиальных клеток. Последующее преимущественное вовлечение или коагуляционного, или тромбоцитарного звена гемостаза, по-видимому, обусловлено степенью и качественными нарушениями сосудистого эндотелия. Накопление вазоактивных субстанций, высвобождаемых из активированных тромбоцитов и поврежденных ЭК, разбухание самих эндотелиальных клеток и накопление агрегатов тромбоцитов способствуют сужению просвета капилляров и артериол почек. Это ведет к уменьшению фильтрующей поверхности, в результате чего снижается скорость клубочковой фильтрации и развивается острая почечная недостаточность. Развитие гемолитической анемии при гемолитико-уремическом синдроме объясняют, с одной стороны, механическим повреждением эритроцитов при прохождении через тромбированные сосуды микроциркуляции, другой причиной гемолиза эритроцитов являются выраженные электролитные нарушения в крови. При этом эритроциты приобретают вид «скорлупок» или «капюшонов».
 [1], [2], [3], [4], [5], [6], [7], [8], [9], [Escherichia coli Infections”>10], [11], [12], [13], [14]
[1], [2], [3], [4], [5], [6], [7], [8], [9], [Escherichia coli Infections”>10], [11], [12], [13], [14]
Патогенез гемолитико-уремического синдрома.
Гемолитико-уремический синдром: симптомы, диагностика, лечение
![]()
Девяносто процентов случаев приходится на детское население, связанное с вспышками гастроэнтерита, вызванными продуцирующей веротоксин Escherichia coli.
Классификация и основные признаки
Уремический гемолитический синдром имеет две формы, их определяет наличие особых симптомов:
- Типичное развитие болезни, основным признаком является диарея. В большинстве случаев диагностируется у детей младшей возрастной группы.
- Атипичный гус, или спорадический. Пациент не жалуется на наличие диареи. В большинстве случаев выявляется у взрослых и детей старше 5 лет.
В зависимости от причины возникновения ГУС может быть:
- наследственным;
- постинфекционным;
- лекарственным;
- поствакцинальным;
- идиопатическим.
Гемолитико-уремический синдром может развиваться в нескольких формах, которые отличаются наличием определенных признаков, тяжестью их проявлений.
ГУС развивается в три выраженных этапа:
1. Продромальный, его длительность составляет около 7 дней. В этот период появляются предвестники развития синдрома – признаки нарушения деятельности желудка, кишечника или симптомы, указывающие на поражение органов дыхания. Больной жалуется на сильную слабость, у него повышается температура тела, бледнеют или изменяют цвет кожные покровы. Заметна отечность на лице – наблюдается пастозность век, областей носа и губ. Снижается количество мочи. Наблюдается реакция со стороны нервной системы – человек становится раздражительным, беспокойным, или, напротив, безразличным и заторможенным.
2. Фаза разгара синдрома, для которой характерно проявление его основных симптомов – почечной недостаточности острого характера, гемолитической анемии, уменьшением количества тромбоцитов в крови. У пациента сохраняется диарея, затруднена работа мочевыделительной системы. Усиливается потоотделение – такое явление называется «кожное дыхание». Больной остается бледным, на его коже могут появиться кровоизлияния и сыпь, которую называют петехиальной. Высыпания могут быть красного, фиолетового, пурпурного цвета. Пациента сопровождают частные носовые кровотечения. В его каловых массах может присутствовать кровь.
Для основного этапа развития ГУС характерны дополнительные признаки:
- повышенная или пониженная возбудимость, неадекватные проявления эмоций, иногда больной впадает в коматозное состояние;
- в мышцах возникает напряжение, миоклонические приступы – подергивания, сокращение групп мышц непроизвольного характера;
- неустойчивые показатели артериального давления – сначала пациент испытывает признаки гипотонии, затем значения АД становятся выше нормы;
- изменяется работа сердца;
- нарушаются обменные процессы, возникает ацидоз.
3. Восстановительная фаза. Для неё характерна постепенная стабилизация состояния, начало восстановления показателей работоспособности организма. У пациента увеличивается уровень тромбоцитов в крови, происходит постепенная нормализация процесса вывода мочи, затем повышение гемоглобинового показателя.
Когда у больного подтверждается агус, заболевание может стать свидетельством обострения основной патологии с характерными для нее симптомами.
Больной жалуется на сильную слабость, у него повышается температура тела, бледнеют или изменяют цвет кожные покровы.
Университет
Фото носит иллюстративный характер. Из открытых источников.
>> Сергей Байко, доцент 1-й кафедры детских болезней БГМУ, кандидат мед. наук.
Гемолитико-уремический синдром (ГУС) — наиболее частая причина острой почечной недостаточности (ОПН) у детей раннего возраста. Ежегодно в Республиканский центр детской нефрологии и почечной заместительной терапии поступает от 20 до 30 пациентов с такой патологией, 75% из них нуждаются в заместительной почечной терапии (ЗПТ).
ГУС — клинико-лабораторный симптомокомплекс, включающий микроангиопатическую гемолитическую анемию, тромбоцитопению и острое почечное повреждение (ОПП).
Пусковым фактором развития заболевания чаще всего служит Escherichia coli, продуцирующая шигаподобный токсин (Stx), типичное проявление заболевания — диарея (ГУС Д+), часто кровянистого характера. В 10–15% случаев ГУС может протекать без диареи (ГУС Д–). ОПН наблюдается в 55–70% случаев. Источники заражения человека шигатоксин-продуцирующими E. coli (STEC) — молоко, мясо, вода; также опасны контакты с инфицированными животными, людьми и их выделениями.
ГУС относится к тромботическим микроангиопатиям, характеризующимся тромбозом сосудов почек. Современная классификация (см. табл. 1) исключает понятия ГУС Д+ и Д–, а содержит варианты в зависимости от причины заболевания: типичный (тГУС), атипичный (аГУС), вызванный Streptococcus pneumoniae (SPA-ГУС).
При поступлении ребенка в стационар и до выявления этиологической причины ГУС можно пользоваться терминами ГУС Д+ и Д–. Однако в последующем требуется уточнение варианта ГУС: STEC-ГУС, SPA-ГУС и т. д.
Наиболее частая форма среди всех вариантов ГУС (90–95% случаев) — тГУС, он ассоциирован с диареей и шигатоксином энтерогеморрагических штаммов E. сoli (STEC-ГУС), реже — с Shigella dysenteriae I типа.
ГУС, не ассоциированный с диареей и шигатоксином, включает гетерогенную группу пациентов, у которых этиологическое значение инфекции, вызванной бактериями, образующими шигатоксин и шигаподобные токсины, исключено. Подразделяется на варианты:
- SPA-ГУС — вызывается Streptococcus pneumoniae, продуцирующим нейраминидазу;
- атипичный ГУС — обусловлен генетическими дефектами белков системы комплемента (фактора H (CFH), I (CFI), B (СFB), мембранного кофакторного протеина (MCP), тромбомодулина (THBD), фракции C3 комплемента) или наличием антител к ним (к фактору H (CFHR 1/3));
- вторичный ГУС — может сопровождать системную красную волчанку, склеродермию, антифосфолипидный синдром; развиваться при приеме противоопухолевых, антитромбоцитарных лексредств, иммунодепрессантов;
- кобаламин С дефицитный ГУС (метилмалоновая ацидурия).
Клиническая классификация ГУС основана на определении тяжести заболевания:
легкая степень — триада симптомов (анемия, тромбоцитопения, ОПП) без нарушений скорости мочеотделения;
- средняя степень — та же триада, осложненная судорожным синдромом и (или) артериальной гипертензией, без нарушений скорости мочеотделения;
- тяжелая степень — триада в сочетании с олигоанурией (или без нее), когда необходима диализная терапия; триада на фоне олигоанурии с артериальной гипертензией и (или) судорожным синдромом, требующая проведения диализа.
Манифестация типичного ГУС отмечается в основном в возрасте от 6 месяцев до 5 лет. При атипичном имеет место раннее начало (возможно даже в период новорожденности), связанное с мутациями генов CFH и CFI (средний возраст первого проявления — 6 месяцев и 2 месяца соответственно). При мутации гена, кодирующего MCP, ГУС всегда дебютирует после года.
В странах Северной Америки и Западной Европы STEC-ГУС в 50–70% случаев — следствие инфекции E. coli, серотип О157:Н7.
Обладает уникальным биохимическим свойством (отсутствие ферментации сорбитола), что позволяет легко отличать его от других фекальных E. coli. Многие другие серотипы E. coli (О111:Н8; О103:Н2; О121; О145; O104:H4; О26 и О113) также вызывают STEC-ГУС. В государствах Азии и Африки основная причина ГУС — Shigella dysenteriae, серотип I.
За последние 10 лет в Беларуси не отмечалось случаев ГУС, вызванных Shigella dysenteriae, серотип I.
После контакта с энтерогеморрагической E. coli у 38–61% пациентов развивается геморрагический колит и только 10–15% инфицированных заболевают ГУС. Общая заболеваемость STEC-ГУС в странах Европы различная: 1,71 случая в год на 100 000 детей до 5 лет и 0,71 — младше 15 лет в Германии; 2 и 0,7 соответственно в Нидерландах; 4,3 и 1,8 в Бельгии; 0,75 и 0,28 в Италии.
Заболеваемость ГУС в Беларуси — одна из самых высоких в Европе: в среднем 4 случая (от 2,7 до 5,3) на 100 000 детского населения в возрасте до 5 лет и 1,5 (1–2) младше 15 лет. Наибольшее количество заболевших регистрируют в Витебской, Гродненской областях и Минске; наименьшее — в Брестской и Гомельской. Пик отмечается в теплое время года (май — август).

STEC-ГУС характеризуется наличием продромального периода в виде диареи. Средний промежуток времени между инфицированием E. coli и возникновением заболевания — трое суток (от одних до восьми). Начинается, как правило, схваткообразными болями в животе и некровянистой диареей. В течение 1–2 дней в 45–60% случаев стул становится кровянистым. Рвота наблюдается в 30–60% случаев, лихорадка в 30%, в крови определяется лейкоцитоз. Рентгенологическое исследование с бариевой клизмой позволяет увидеть картину «отпечатков пальцев», указывающую на отек и кровоизлияния в подслизистый слой, особенно в области восходящей и поперечной ободочной кишки. Артериальная гипертензия в остром периоде ГУС (встречается в 72% случаев) связана с гипергидратацией и активацией ренин-ангиотензин-альдостероновой системы, отличается упорным течением и плохо поддается терапии.
Факторы повышенного риска развития ГУС после инфекции, вызванной E. Coli: кровянистая диарея, лихорадка, рвота, лейкоцитоз, а также крайние возрастные группы, женский пол, использование антибиотиков, угнетающих моторику кишечника. STEC-ГУС не относится к доброкачественным заболеваниям — у 50–75% пациентов развивается олигоанурия, требуется диализ, в 95% случаев переливается эритроцитарная масса, а у 25% отмечается поражение нервной системы, включая инсульт, судороги и кому. Поскольку диализ доступен и есть центры интенсивной терапии, смертность среди младенцев и детей младшего возраста снизилась. Однако до 5% пациентов умирают в острой фазе ГУС.
В Беларуси за последнее десятилетие летальность от STEC-ГУС существенно уменьшилась: с 29,1 (1994–2003) до 2,3% (2005–2014). ГУС, запускаемый S. dysenteriae, почти всегда осложняется бактериемией и септическим шоком, системным внутрисосудистым свертыванием крови и острым некрозом кортикального слоя почек. В таких ситуациях летальность высокая (до 30%).
С инфекцией, вызываемой Streptococcus pneumoniae, связано 40% случаев ГУС, не ассоциированного с шигатоксином, и 4,7% всех эпизодов ГУС у детей в США. Нейраминидаза, образуемая бактериями S. pneumoniae, удаляя сиаловые кислоты с клеточных мембран, обнажает антиген Томсена — Фриденрайха, подвергая его воздействию циркулирующих иммуноглобулинов M. Дальнейшее связывание последних с этим новым антигеном на тромбоцитах и эндотелиальных клетках приводит к агрегации тромбоцитов и повреждению эндотелия. Заболевание обычно протекает тяжело, сопровождается респираторным дистресс-синдромом, неврологическими нарушениями и комой; летальность достигает 50%.
Из лексредств наиболее часто вызывают вторичный ГУС противоопухолевые (митомицин, цисплатин, блеомицин и гемцитабин), иммуннотерапевтические (циклоспорин, такролимус, ОКТ3, хинидин) и антитромбоцитарные (тиклопидин и клопидогрел). Риск развития ГУС после использования митомицина составляет 2–10%. Начало заболевания отсроченное, спустя год после старта терапии. Прогноз неблагоприятный, смертность в течение 4 месяцев достигает 75%.
В литературе описаны случаи посттрансплантационного ГУС. Возможно его появление у пациентов, никогда ранее не переносивших это заболевание (de novo) или у которых он был первичной причиной терминальной почечной недостаточности (рецидивирующий посттрансплантационный ГУС). Запустить посттрансплантационный ГУС, возникший de novo, могут ингибиторы кальциневрина или отторжение по гуморальному типу (С4b положительное). Эта форма ГУС после пересадки почки возникает у 5–15% пациентов, получающих циклоспорин А, и приблизительно у 1% употребляющих такролимус.
ГУС на фоне беременности иногда развивается как осложнение преэклампсии. У некоторых вариант жизнеугрожающий, сопровождается тяжелой тромбоцитопенией, микроангиопатической гемолитической анемией, почечной недостаточностью и поражением печени (HELLP-синдром). В таких ситуациях показано экстренное родоразрешение — за ним следует полная ремиссия.
Послеродовый ГУС в основном проявляется в течение 3 месяцев после родов. Исход обычно неблагоприятный, смертность составляет 50–60%.
Для атипичного ГУС, обусловленного генетическими дефектами белков системы комплемента, характерна триада основных признаков, сопровождающаяся волнообразным и рецидивирующим течением. Эта форма может быть спорадической или семейной (заболевание отмечается более чем у одного члена семьи и воздействие Stx исключено). Прогноз при аГУС неблагоприятный: 50% случаев протекает с развитием терминальной почечной недостаточности или необратимого повреждения головного мозга, летальность в острой фазе достигает 25%.
ЛАБОРАТОРНАЯ ДИАГНОСТИКА И КРИТЕРИИ Микроангиопатический гемолиз при ГУС характеризуется:
- снижением уровней гемоглобина и гаптоглобина;
- повышением лактатдегидрогеназы (ЛДГ), свободного гемоглобина плазмы и билирубина (преимущественно непрямого), ретикулоцитов;
- появлением шизоцитоза в периферической крови (более 1%),
- отрицательной реакцией Кумбса (отсутствие антиэритроцитарных антител).
Тромбоцитопения диагностируется при количестве тромбоцитов периферической крови менее 150109/л. Cнижение уровня тромбоцитов более чем на 25% от исходного (даже в пределах возрастной нормы) свидетельствует о повышенном их потреблении и отражает развитие ГУС.
Уровень сывороточного креатинина, расчетная скорость клубочковой фильтрации позволяют определить стадию ОПП (см. табл. 2). 
* Для вычисления расчетной скорости клубочковой фильтрации используется формула Шварца.
** При отсутствии исходных уровней креатинина для оценки его повышения можно использовать верхнюю границу нормы для соответствующего возраста ребенка.
*** У детей до 1 года олигурия определяется при снижении скорости мочеотделения менее 1 мл/кг/ч.
Для выявления перехода преренального ОПП в ренальное или первой стадии во вторую определяют уровни нейтрофильного желатиназа-ассоциированного липокалина (NGAL) в крови и (или) моче. Степень повышения NGAL отражает тяжесть ОПП.
Ранний маркер снижения скорости клубочковой фильтрации — цистатин С в крови.
Диагноз «STEC-ГУС» подтверждается выделением E. coli в культурах кала ребенка (для диагностики E. coli O157 используется среда с сорбитолом). Антигены E. coli O157 и шигатоксина выявляются методом полимеразной цепной реакции в образцах стула.
Для подтверждения инфекционной природы ГУС применяют серологические тесты на антитела к шигатоксину или к липополисахаридам энтерогеморрагических штаммов E. coli. Ранняя диагностика предполагает использование экспресс-тестов для выявления антигенов E. coli O157:H7 и шигатоксина в стуле.
Для исключения сепсиса определяют С-реактивный белок, прокальцитонин, пресепсин крови.
Всем пациентам необходимо исследовать С3- и С4-фракции комплемента крови для оценки выраженности и путей его активации, а в некоторых случаях — для подтверждения атипичного течения ГУС.
Если у ребенка при ГУС нет диареи в продромальном периоде, в первую очередь следует исключить развитие SPA-ГУС.
Учитываются имеющиеся или ранее перенесенные заболевания, которые чаще всего вызываются
S. pneumoniae: пневмония, отит, менингит. Для выявления возбудителя проводятся культуральные исследования крови, ликвора и (или) экспресс-диагностика антигенов S. pneumoniae в моче.
У пациентов с ГУС, имеющих неврологическую симптоматику (судорожный синдром, угнетение сознания, кома), для исключения тромботической тромбоцитопенической пурпуры (ТТП) оценивается активность металлопротеиназы крови, расщепляющей мультимеры фактора фон Виллебранда (ADAMTS-13). Для ТТП характерны неврологическая симптоматика, низкие уровни тромбоцитов (30х109/л), отсутствие или умеренная азотемия (креатинин крови не более 150–200 мкмоль/л), лихорадка, снижение активности ADAMTS-13 менее 10% (до проведения плазмотерапии).
Развитие симптомокомплекса ГУС у младенца до 6 месяцев требует исключения метилмалоновой ацидурии. При подозрении на эту патологию проводится анализ уровней аминокислот — изолейцина, валина, метионина и треонина; определяется содержание ацилкарнитинов и гомоцистеина в крови пациента, почечной экскреции гомоцистеина и органических кислот — метилмалоновой, 3-гидроксипропионовой, 3-гидрокси-n-валериановой, метиллимонной, пропионилглицина. Молекулярно-генетическое исследование подтвержает диагноз, если выявляются мутации в генах MUT, MMAA, MMAВ, ММАСНС, ММАDHC, MCEE.
Перечень диагностических процедур для постановки диагноза «ГУС» включает основные манипуляции, которых в большинстве случаев достаточно для верификации диагноза, и дополнительные, необходимые при редких вариантах заболевания и осложнениях.
- общий анализ крови (количество тромбоцитов, лейкоцитарная формула, СОЭ — при возможности с подсчетом процента шизоцитов);
- кислотно-основное состояние;
- биохимическое исследование крови (определяются уровни общего белка, альбумина, креатинина, мочевины, аланинаминотрансферазы, аспартатаминотрансферазы, ЛДГ, билирубина общего и прямого, глюкозы, калия, натрия, хлора, кальция, С-реактивного белка);
- общий анализ мочи (при ее наличии);
- коагулограмма;
- определение группы крови (по системам АВ0) и резус-фактора;
- прямая проба Кумбса (уровень антиэритроцитарных антител);
- исследование кала экспресс-методами для выявления шигатоксина (первого и второго типа) и антигенов E. coli O157 и (или) выделение культур шигатоксина, содержащих E. coli, на специальных средах (с сорбитолом для E. coli O157:H7) либо обнаружение их ДНК в образцах стула;
- анализ кала на патогенную кишечную флору;
- УЗИ почек и мочевого пузыря.
Дополнительные исследования:
- при биохимическом анализе — исследование цистатина С, гаптоглобина, прокальцитонина, пресепсина;
- для коагулограммы — выявление уровней растворимых фибрин-мономерных комплексов, D-димеров;
- определение белков системы комплемента крови — С3 и С4;
- исследование уровней факторов H, I, MCP (CD46) в крови;
- вычисление уровней гомоцистеина крови, метилмалоновой кислоты (крови и мочи) ± молекулярно-генетическое исследование для выявления мутаций в гене MMACHC;
- контроль уровней NGAL в крови и моче;
- тест на беременность (следует делать всем девочкам-подросткам с клиникой ГУС или ТТП);
- определение активности ADAMTS-13 и антител к ADAMTS-13 в крови;
- поиск антител к шигатоксину и (или) липополисахаридам STEC в сыворотке крови через 7–14 дней от начала диареи (повторно — через 7–10 дней);
- определение аутоантител к фактору H в крови;
- молекулярно-генетическое исследование для выявления мутаций генов, кодирующих белки системы комплемента;
- УЗИ почек с оценкой почечного кровотока и состояния мочевого пузыря.
Показатели, позволяющие проводить дифференциальную диагностику, перечислены в таблице 3.

Залог успешного ведения детей с ГУС — ранняя диагностика заболевания и своевременное начало поддерживающего лечения.
Не существует терапии тГУС с доказанной эффективностью. Во время острой фазы нужна исключительно поддерживающая. Комплекс лечебных мероприятий включает этиотропную, посиндромную, патогенетическую и заместительную почечную терапию.

Случаи из практики
Данное заключение позволило 11 октября поставить пациента в лист ожидания почечного трансплантата, а 8 декабря следующего года ему успешно выполнена трансплантация донорской почки. Уже более 2,5 года сохраняется удовлетворительная функция трансплантата.
Медицинский вестник, 12, 17 октября 2016
Развитие симптомокомплекса ГУС у младенца до 6 месяцев требует исключения метилмалоновой ацидурии.
Патогенез гемолитико-уремического синдрома
Гемолитико-уремический синдром, ассоциированный с пневмококковой инфекцией – редкая патология, развивающаяся в основном у детей раннего возраста. В этом обзоре представлены современные данные о патофизиологии, клинической картине и методах лечения этого заболевания и обсуждаются трудности диагностики.
Гемолитико-уремический синдром (ГУС) относится к группе заболеваний с различными этиологией и патогенезом, при которых развиваются тромбозы в микроциркуляторном русле и которые объединяются термином «тромботическая микроангиопатия» (ТМА). При ГУС, помимо ишемических поражений органов (прежде всего почек), развиваются тромбоци-топения потребления и микро-ангиопатическая неиммунная гемолитическая анемия, отличительным признаком которой является наличие в циркуляции более 1% фрагментированных эритроцитов (шизоцитов). При этом присутствуют и другие лабораторные маркёры внутри-сосудистого гемолиза, такие, как повышение уровня лактатде-гидрогеназы и снижение уровня гаптоглобина плазмы. ГУС наиболее часто возникает на фоне инфекции, вызванной кишечной палочкой, продуцирующей ши-га-токсин (STEC). Но это не единственное инфекционное заболевание, осложняющееся данным синдромом. Необходимо помнить и об особой форме ГУС, которая развивается при пневмококковой инфекции. Shenk et al. в 1970 г. описали при пневмококковой септицемии 3 случая тромбоцитопении в сочетании с тромбозом гло-мерул и почечных артериол. Авторы в своей публикации не применяли термин ГУС и не сообщили о том, была ли у пациентов гемолитическая анемия. В 1971 г. Fisher et al. впервые описали развитие ГУС на фоне пневмококковой инфекции, а в 1977 г. Klein et al. представили первую аналогичную публикацию на английском языке. В последующие 10 лет, с 1977 по 1987 г. в англоязычной литературе были опубликованы наблюдения за 12 детьми с ГУС, ассоциированным с пневмококковой инфекцией (ПГУС) с очень серьёзным прогнозом: 6 детей умерли в острый период, а ещё у 4 развилась хроническая болезнь почек.
ПГУС – редкое заболевание, составляющее около 5% всех случаев ГУС у детей. На фоне инвазивной пневмококковой инфекции ПГУС развивается в 0,4-0,6% случаев. Тем не менее многие авторы считают, что встречаемость этой формы ГУС может быть выше, так как недостаточная насторожённость педиатров и инфекционистов в этом плане может приводить к ошибкам диагностики, при которых ПГУС принимается за синдром диссеминированного внутрисосудистого свёртывания крови (ДВС-синдром), развитие которого нередко предполагается при тяжёлом инфекционном процессе и может возникать параллельно с ПГУС. Наиболее часто ПГУС встречается у детей младше 5 лет и крайне редко у взрослых. К моменту подготовки данной статьи к печати в англоязычной литературе было описано всего 4 случая этого заболевания у взрослых, причём у 2 пациентов в недавнем анамнезе присутствовала сплен-эктомия. В PubMed за последние 35 лет имеется описание в общей сложности 85 случаев ПГУС у детей, из которых у 61 (72%) это осложнение развилось на фоне пневмонии и/или эмпиемы плевры, у 20 (23%) – на фоне менингита, а у 4 больных (5%) отмечалось сочетание пневмонии с менингитом на фоне пневмококкового сепсиса.
Патогенетические механизмы ПГУС остаются не вполне ясными. Однако не вызывает сомнения роль антигена Томсена – Фриденрейха (Т-антиген).
Т-антиген является компонентом многих мембранных и сывороточных гликопротеинов и гликолипидов и входит в структуру мембран эритроцитов, тромбоцитов и гломерулярного эндотелия. В норме он «зашифрован», то есть является криптантигеном, так как покрыт сиаловыми кислотами и поэтому не распознаётся анти-Т-антителами. Естественные анти-Т-антитела, относящиеся к классу IgM, в норме присутствуют в сыворотке крови каждого человека и их уровень практически постоянен с периода новорождённости. Пневмококки выделяют нейраминидазу, которая способна разрушить N-ацетил-нейраминовую кислоту поверхности клеток, делая Т-антиген эритроцитов, тромбоцитов и эндотелия доступным для взаимодействия с собственными IgM-антителами, что инициирует каскад событий, приводящих к развитию ПГУС. Активированный Т-антиген присутствует также на гепатоци-тах, чем объясняется развитие транзиторной печёночной дисфункции у некоторых пациентов. Обнажение Т-антигена на эритроцитах и его взаимодействие с антителами приводит к различным лабораторным феноменам, которые могут иметь определённое значение для диагностики. В частности, у 90% больных с ПГУС отмечается положительная прямая реакция Кумбса, и этот тест является очень чувствительным. У ряда пациентов, в связи с неспецифической агглютинацией, могут выявляться трудности при проведении ABO кросс-матча. Но, к сожалению, неизвестна специфичность этих тестов, так как не проводились достоверные исследования их встречаемости при пневмококковой инфекции, не осложнённой ГУС.
У всех серотипов S. pneumonia встречаются штаммы с активностью нейраминидазы, достаточной для активации Т-антигена. Поэтому любая инвазивная пневмококковая инфекция потенциально способна вызывать определённый спектр патологических состояний от изолированной гемолитической анемии до развёрнутой клинической картины ПГУС. Некоторые авторы предполагают, что распространённость инфекционного процесса и степень «бактериальной нагрузки» оказывают влияние на риск развития ПГУС. Эта гипотеза основывается на фактах более частого развития ПГУС у пациентов с пневмонией в сочетании с плевральными осложнениями.
ПГУС обычно развивается на 3-13-й день (чаще с 7-го по 9-й) после начала пневмококковой инфекции, что сближает это состояние со STEC ГУС, который также развивается не с 1-го дня инфекционного заболевания. Мальчики и девочки поражаются в равной степени. Дети с ПГУС в среднем обычно младше детей со STEC ГУС, имеют более тяжёлые начальные проявления и более длительный период олигоанурии. Они чаще нуждаются в диализе и переливании эритромассы. В сериях пациентов (в общей сложности 73 ребёнка), которые были описаны за последние 25 лет (1987-2012 гг.), 9 (12,3%) умерли в острую фазу болезни и 8 (10,3%) развили хроническое заболевание почек. Эти показатели более чем в 2 раза превышают аналогичные данные при STEC ГУС. Однако необходимо отметить, что летальные исходы при ПГУС в ряде случаев могли быть обусловлены в большей степени самим тяжёлым инфекционным процессом (менингит, сепсис), чем ГУС.
У пациентов с пневмококковой инфекцией нелегко отличить ГУС от ДВС-синдрома, так как при этих состояниях в равной степени развивается микроан-гиопатическая гемолитическая анемия, тромбоцитопения и острое повреждение почек. Однако в большинстве случаев ПГУС уровни фибриногена и протромбина плазмы остаются нормальными, частичное тром-бопластиновое время не изменяется значительно, и отсутствуют активные кровотечения. Положительная прямая реакция Кумбса при пневмококковой инфекции является серьёзным свидетельством активации Т-антигена и повышает вероятность ПГУС. Более того, положительная реакция Кумбса не характерна для ДВС-синдрома и для других вариантов ГУС. Морфологическое выявление тромботической микроангио-патии (ТМА) при исследовании почечных биоптатов может быть полезно для дифференциальной диагностики с острым канальцевым некрозом, но не позволяет отличить ПГУС от ДВС-синдрома, и тяжёлое общее состояние многих пациентов затрудняет проведение этой диагностической процедуры. Ряд авторов считает возможным одновременное развитие у пациентов с пневмококковой инфекцией ПГУС, и ДВС-синдрома. При этом ПГУС обусловлен воздействием ней-раминидазы, а ДВС-синдром является результатом массивного освобождения из тканей тромбопластических веществ. В этой сложной для диагностики и запутанной ситуации известная клиническая триада (острая почечная недостаточность, тромбоцитопения и микроангиопатическая гемолитическая анемия) будет сочетаться с изменением коагуляционных тестов и положительной реакцией Кумбса. В ранних публикациях предполагалось, что для диагностики пневмококкового ГУС может иметь значение выявление активности нейраминидазы сыворотки крови. Однако в последующем было показано, что это исследование обладает высокой чувствительностью (100%) в плане диагностики любой инвазивной пневмококковой инфекции, включая и неосложённую пневмонию, и низкой специфичностью в отношении ПГУС. Становится очевидным, что для развития ПГУС недостаточно одной только высокой активности нейраминидазы и, вероятно, требуются дополнительные, ещё неизвестные факторы.
Было сделано несколько попыток более конкретного клинического определения ПГУС. The Canadian Paediatric Surveillance Program разделила всех пациентов с инвазивной пневмококковой инфекцией и признаками микроангиопатической гемолитической анемии на две категории. К явным случаям (Definite cases) были отнесены пациенты, у которых определялась ТМА при биопсии почки или при аутопсии. К случаям вероятного ПГУС (Possible cases) были отнесены пациенты, у которых не представлялось возможным отличить ГУС от ДВС-синдрома с вторичной органной недостаточностью. Copelovitch et al. в 2010 г. модифицировали эти подходы, не включив морфологические признаки в качестве критерия диагностики, в связи с их однотипностью при ГУС и ДВС-синдроме. С 1988 по 2009 г. в Филадельфии (США) авторы наблюдали 14 случаев ПГУС. В процессе постановки диагноза к явным случаям они относили пациентов с доказанной инвазивной пневмококковой инфекцией (положительный результат посева крови и/или плеврального экссудата), клинической триадой, характерной для ГУС при отсутствии лабораторных доказательств наличия ДВС-синдрома. В тех случаях, когда при подобной клинической картине коагуляци-онные тесты выявляли снижение уровня фибириногена плазмы и значительное удлинение про-тромбинового и/или частичного тромбопластинового времени, авторы диагностировали ДВС-синдром. Небольшое удлинение протромбинового и/или частичного тромбопластинового времени при нормальном уровне фибриногена не расценивалось авторами как ДВС-синдром. Учитывая известную низкую высеваемость пневмококка из крови (не более 30% при пневмонии), авторы расширили применение критерия Possible cases (вероятность ГУС), распространив его на пациентов с пневмонией или менингитом, у которых хотя и не был идентифицирован возбудитель, имелась клиника ГУС, положительный тест Кумбса и отсутствие лабораторных признаков ДВС-синдрома.
Терапия ПГУС направлена на поддержание водно-электролитного баланса, нутритивного статуса, коррекцию анемии и других возможных осложнений. Больные часто нуждаются в проведении диализа или ге-модиафильтрации. В связи с распространением резистентных к антибиотикам штаммов пневмококка Американская академия педиатрии рекомендует начинать эмпирическое лечение критически больных детей с предполагаемой или доказанной пневмококковой инфекцией комбинацией ванко-мицина и цефалоспоринов широкого спектра. В связи с тем, что донорская плазма содержит IgM-антитела к Т-антигену, её применение противопоказано за исключением случаев сочетания ПГУС с опасным для жизни кровотечением на фоне ДВС-синдрома. По этой же причине при развитии тяжёлой анемии для гемотрансфузий предпочтительно использовать отмытые эритроциты, так как современные технологии позволяют удалять до 95% плазмы с поверхности клеток. Теоретически можно было бы предположить терапевтическую эффективность плазмафере-за, позволяющего удалять из циркуляции бактериальную нейраминидазу. К настоящему моменту имеются единичные публикации на эту тему. Авторы отмечают положительный эффект от плазмафереза, но и обращают внимание на необходимость замещения удалённой плазмы альбумином, в связи с противопоказаниями к использованию донорской плазмы.
Таким образом, ПГУС является трудным для диагностики, но тем не менее ярко очерченным осложнением пневмококковой инфекции у детей раннего возраста. Сложности диагностики обусловлены отсутствием пато-гномоничных лабораторных тестов и схожестью клиники ПГУС с клиникой ДВС-синдрома, развитие которого также возможно у пациентов с тяжёлой пневмококковой инфекцией. Ранняя диагностика ПГУС может иметь важное значение, так как диктует отказ от опасных для данных пациентов инфузий плазмы. С практической точки зрения представляется правильным диагностировать эту форму ГУС у тех детей, у которых при инвазивной пневмококковой инфекции развивается острое повреждение почек, тромбо-цитопения и микроангиопати-ческая гемолитическая анемия с положительной прямой реакцией Кумбса при отсутствии лабораторных доказательств ДВС-синдрома.
Михаил КАГАН, нефролог.
Областная детская клиническая больница.
Оренбург.
Небольшое удлинение протромбинового и или частичного тромбопластинового времени при нормальном уровне фибриногена не расценивалось авторами как ДВС-синдром.
Гемолитико-уремический синдром

Гемолитико-уремический синдром (болезнь Гассера) – тяжелое полиэтиологическое расстройство, проявляющееся сочетанием неиммунной гемолитической анемии, тромбоцитопении и острой почечной недостаточности. Гемолитико-уремический синдром наблюдается преимущественно у детей грудного и младшего возраста (с 6 мес. до 4 лет), но также встречается у детей старшего возраста и редко у взрослых. Ежегодно в расчете на 100 тыс. детского населения регистрируются 2-3 случая гемолитико-уремического синдрома у детей до 5 лет и 1 случай у детей до 18 лет. Поскольку гемолитико-уремический синдром — одна из частых причин острой почечной недостаточности у детей, то от своевременности его диагностики и лечения зависит исход заболевания.
В зависимости от этиологии и клинических особенностей разделяют гемолитико-уремический синдром диареяассоциированный Д типичный и не ассоциированный с диареей Д- спорадический или атипичный.
Атипичный гемолитико-уремический синдром (аГУС)

Атипичный гемолитико-уремический синдром (аГУС)
Атипичный гемолитико-уремический синдром (аГУС) — это чрезвычайно редкое (орфанное) заболевание, связанное с недостаточностью альтернативного пути активации комплемента. По системе МКБ-10 кодируется, как D 59.3
Атипичный гемолитико-уремический синдром (аГУС). Прогноз. Причины.
К сожалению, прогноз заболевания, чаще всего, неблагоприятный. Атипичный гемолитико-уремический синдром (аГУС) – это угрожающая жизни хроническая болезнь, характеризующаяся мультисистемным поражением органов и тканей. Заболевание примерно одинаково встречается как у детей, так и у взрослых. В основе заболевания лежит тромботическая микроангиопатия (TMA), при которой в маленьких кровеносных сосудах возникают тромбы. Из-за этого нарушается кровоснабжение, и органы страдают.
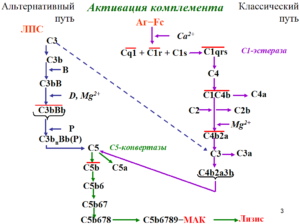 Причина болезни – сбой в системе комплемента, его очень активная деятельность вместо того, чтобы защищать организм, начинает его разрушать. Контролируют уровень активность особые белки, при атипичным гемолитико-уремический синдроме (аГУС) их функция значительно нарушена, и процесс выходит из под контроля.
Причина болезни – сбой в системе комплемента, его очень активная деятельность вместо того, чтобы защищать организм, начинает его разрушать. Контролируют уровень активность особые белки, при атипичным гемолитико-уремический синдроме (аГУС) их функция значительно нарушена, и процесс выходит из под контроля.
Чем дольше длится токсическое агрессивное воздействие на организм, тем более пагубными становятся последствия: отказывают почки, развивается инсульт или инфаркт.
Соответственно, при ранней диагностике, при выявлении заболевания на начальных стадиях, можно снизить пагубное воздействие атипичного гемолитико-уремического синдрома (аГУС), и тем самым дать шанс человеку на нормальную полноценную жизнь.
Атипичный гемолитико-уремический синдром (аГУС). Наследование.
Атипичный гемолитико-уремический синдром (аГУС) считается наследственным заболеванием только в 20% случаев, с аутосомно-рецессивным или доминантным типом передачи. Примерно в половине случаев выявить генетическую мутацию не получается. Поэтому ДНК – анализ при атипичном гемолитико-уремическом синдроме (аГУС) не является важнейшим диагностическим методом, на его основании не может даваться заключение о начале или отмене терапии.
Атипичный гемолитико-уремический синдром (аГУС) одинаково распространен по всей планете, не выявлено зависимости от пола или расы пациентов. Из-за редкости заболевания сложно говорить о точном количестве пациентов, есть предположения о том, что болезнь встречается примерно от 1 до 9 случаев на миллион человек.
Атипичный гемолитико-уремический синдром (аГУС). Клинические проявления.
Симптомы атипичного гемолитико-уремического синдрома (аГУС) встречаются как все вместе, так и по отдельности. Насторожить должно любое из клинических проявлений болезни.
Итак, симптомами атипичного гемолитико-уремического синдрома (аГУС) являются:
- Постоянная усталость и недомогание;
- Поражение почек вплоть до необходимости гемодиализа из-за терминальной почечной недостаточности;
- Отеки, тяжесть в ногах;
- Снижение диуреза;
- Повышение креатинина крови;
- Снижение скорости клубочковой фильтрации;
- Артериальная гипертензия;
- Внепочечный тромбоз;
- Протеинурия;
- Энцефалопатия;
- Спутанность сознания;
- Судороги;
- Инсульт;
- Инфаркт;
- Кардиомиопатия с развитием сердечной недостаточности;
- Высокое артериальное давление;
- Поражение глазных сосудов;
- Поражение легких;
- Поражение кожи. Сыпь;
- Боли в животе;
- Диарея;
- Рвота;
- Колит;
- Панкреатит.
Вызывать проявления атипичного гемолитико-уремического синдрома (аГУС) могут несколько причин, зачастую они становятся спусковым крючком для начала заболевания. Вот они:
- Диарея;
- Гастроэнтерит;
- Инфекции верхних дыхательных путей;
- Беременность и роды;
- Гломерулопатия;
- Склеродермия;
- Системная красная волчанка;
- Злокачественная артериальная гипертензия;
- Злокачественные новообразования;
- Трансплантация почки и костного мозга.
Все они усиливают нарушение в системе комплемента. Иногда для манифестации заболевания бывает достаточно одного фактора, но они могут действовать и в совокупности.
Атипичный гемолитико-уремический синдром (аГУС). Диагностика.
 Тромботическая микроангиопатия (TMA) – результат атипичного гемолитико-уремического синдрома (аГУС), но вызвать такое тяжелое последствие может не только аГУС, но и другие заболевания. Поэтому так важно проводить дифференциальную диагностику, чтобы квалифицировать именно манифестицию атипичного гемолитико-уремического синдрома (аГУС).
Тромботическая микроангиопатия (TMA) – результат атипичного гемолитико-уремического синдрома (аГУС), но вызвать такое тяжелое последствие может не только аГУС, но и другие заболевания. Поэтому так важно проводить дифференциальную диагностику, чтобы квалифицировать именно манифестицию атипичного гемолитико-уремического синдрома (аГУС).
Во-первых, атипичный гемолитико-уремический синдром (аГУС) не имеет в самом начале возникновения заболевания проявлений гемоколита, во-вторых диарея может сама по себе вызвать заболевание, а не быть его симптомом. На этом этапе нужно исключить STEC и Streptococcus pneumoniae – инфекции.
Дальше методом исключения проверяем пациента на системную красную волчанку, СПИД, злокачественную гипертонию, тромботическую тромбоцитопеническую пурпуру, HELLP — синдром у рожающих женщин и ряд других заболеваний.
Напоминаем, что генетический анализ не имеет 100% достоверности, у части пациентов с подтвержденным атипичным гемолитико-уремическим синдромом (аГУС), нарушения в соответствующем гене не выявлены.
Атипичный гемолитико-уремический синдром (аГУС). Лечение.
Лечение инфузиями плазмы, пламообменом. В настоящий момент метод считается недостаточно эффективным, у одних пациентов он вызывает незначительное улучшение показателей, а у других оказывается практически бесполезным.
Гемодиализ. Процедура искусственной очистки организма лишь устраняет последствия сбоя в системе комплемента, но при этом никак не влияет на процесс избыточного образования белка. Она способна на несколько лет увеличить продолжительность жизни пациента. Сохраняется возможность развития внепочечной тромботической микроангиопатии.
Трансплантация. Почка, потерявшая свою функцию, может быть заменена на новую, но прогрессирующее заболевание может вновь начать разрушать органы и ткани. 90% пациентов опять чувствуют симптомы атипичного гемолитико-уремического синдрома (аГУС). Есть большой риск рецидива после трансплантации. Иногда можно осуществить двойную трансплантацию, и печени, и почки, но при этом возникает огромная сложность в поиске идеально подходящих двух донорских органов. Кроме того, и такая сложнейшая манипуляция может не дать гарантированного положительного результата. Тромботическая микроангиопатия развивается и в других органах.
 Экулизумаб. Единственный препарат, который воздействует на механизм развития заболевания, а не на последствия болезни. Экулизумаб связывает компонент комплемента и тем самым предотвращает накопление негативных факторов. Препарат зарегистрирован в России и доказал свою эффективность. Люди с атипичным гемолитико-уремическим синдромом (аГУС) не чувствуют постоянную усталость, у них не развивается поражение органов и тканей. Внедрение в лечебную практику экулизумаба, гуманизированного моноклонального антитела к С5 — фракции терминальной стадии каскада комплемента, значительно увеличивает продолжительность жизни пациентов, а сама жизнь становится полноценной.
Экулизумаб. Единственный препарат, который воздействует на механизм развития заболевания, а не на последствия болезни. Экулизумаб связывает компонент комплемента и тем самым предотвращает накопление негативных факторов. Препарат зарегистрирован в России и доказал свою эффективность. Люди с атипичным гемолитико-уремическим синдромом (аГУС) не чувствуют постоянную усталость, у них не развивается поражение органов и тканей. Внедрение в лечебную практику экулизумаба, гуманизированного моноклонального антитела к С5 — фракции терминальной стадии каскада комплемента, значительно увеличивает продолжительность жизни пациентов, а сама жизнь становится полноценной.
Атипичный гемолитико-уремический синдром аГУС.
6.2. Гемолитико-уремический синдром
Гемолитико-уремический синдром (ГУС) характеризуется со четанием гемолитической анемии, тромбоцитопении и азотемии. В Северной Америке частота ГУС на фоне кишечной инфекции составляет 2 — 3 случая на 100 000 детей в возрасте до 5 лет, в Аргентине — в 10 раз выше. Эндемичными по ГУС считаются Ар гентина, ЮАР, Бангладеш. В России ГУС встречается в районе Поволжья и Московском регионе, в США эндемичной по ГУС является Калифорния.
В зависимости от этиологии и клинических особенностей ГУС подразделяется на диареяассоциированный (Б + -ГУС), или типич ный, и не ассоциированный с диареей (D-ГУС). В этиологии Б + -ГУС основную роль играет энтерогеморрагическая Е. coli 0157 :Н7. Этот возбудитель выделяет специфический токсин — веротоксин (шигатоксин). Он действует на эндотелиальные клет ки, имеющие специфические рецепторы веротоксина, представ ленные глоботриаозилцереброзидом. У детей первых 3 лет жизни за счет иного состава жирных кислот в структуре данных рецепто ров возникает большее сродство веротоксина с эндотелием ка пилляров почки, в результате чего угроза развития ГУС во много раз превышает таковую у детей более старшего возраста и взрос лых. Определенную роль в возникновении Б + -ГУС играют также S. dysenteriae I типа, способные продуцировать шигатоксин, ко торый является не только цитотоксином, но и нейротоксином.
Наиболее часто Б + -ГУС встречается у детей раннего возраста в теплое время года на фоне кишечной инфекции, вызываемой Escherichia coli. На фоне вирусных инфекций этот синдром воз никает преимущественно в зимне-весенний период.
При D-ГУС связь с диареей, возрастом и сезонностью не вы является. Постинфекционный D-ГУС вызывают S. pneumoniae (секретирующий нейроаминидазу, способную повреждать мемб раны эритроцитов, тромбоцитов, эндотелиоцитов) и ряд виру сов (Коксаки, Эпштейна —Барр, ВИЧ, гриппа). Помимо постинфекционного D-ГУС в данную группу включается лекарствен ный (химиопрепараты, оральные контрацептивы) и поствакци-
нальный (после прививки живыми вакцинами, АКДС) ГУС, а также ГУС при системных заболеваниях соединительной ткани и наследственный ГУС. При последнем у больных выявляются му тации гена, кодирующего фактор Н (регулятор комплемента), а также аномалии синтеза простагландина 1 2 .
Патогенез и патоморфология
Основной патологический агент при Б + -ГУС — веротоксин, способный повреждать клетки эндотелия сосудов почек и голов ного мозга. В системной циркуляции крови веротоксин быстро связывается с моноцитами и гранулоцитами. Присоединение веротоксина к моноцитам вызывает высвобождение цитокинов, способствующих увеличению числа эндотелиальных рецепторов к данному токсину, а продуцируемые нейтрофилами активные фор мы кислорода, протеолитические ферменты и медиаторы воспа ления (ИЛ-1, ФНО) повреждают клеточные мембраны эндоте лиальных клеток и эритроцитов. Эритроциты становятся более чувствительными к механической травме и легко разрушаются. Помимо этого благодаря развивающемуся патологическому про цессу в почках гемолиз эритроцитов усиливается. Это происходит за счет активации коагулянтного каскада и отложения фибрина внутри сосудов. Эритроциты, проходя через суженные изменен ные гломерулярные капилляры, разрезаются нитями фибрина и фрагментируются. Указанные механизмы лежат в основе харак терных признаков микроангиопатической гемолитической анемии.
Тромбоцитопения является результатом комбинации несколь ких факторов. Высокая экспрессия рецепторов веротоксина обу словливает веротоксининдуцированную активацию тромбоцитов, а эндотелий капилляров при этом становится более чувствитель ным к активированным тромбоцитам. Повреждение эндотелиаль ной выстилки гломерулярных капилляров под влиянием вероток сина, гемолиз эритроцитов с высвобождением из них тромбопла стических веществ, активация и потребление тромбоцитов при водят к развитию локальной коагуляции в капиллярах почек с отложением в них фибрина и возникновению ДВС-синдрома (см. подразд. 6.3). В процессе развития внутрисосудистой коагуляции как следствие высокого потребления тромбоцитов возникает Тром боцитопения. Усилению тромбоцитопении способствует и проис ходящая в гломерулярных капиллярах деструкция тромбоцитов, аналогичная деструкции эритроцитов.
Нарушение коагуляции при ГУС характеризуется повышением уровня протромботических веществ (тромбоцитактивирующего фактора, фактора Виллебранда, тромбоксана А 2 ) и недостаточ ностью антитромботических факторов (простагландина 1 2 , ткане
вого активатора плазминогена и гепариноподобных молекул, ак тивирующих антитромбин III).
От масштаба распространенности внутрисосудистого сверты вания крови в гломерулах зависит степень поражения почек. Вслед ствие поражения почечных клубочков гломерулярная фильтрация снижается вплоть до формирования при массивном поражении клинической картины острой почечной недостаточности (ОПН).
Особенностью иммунокомплексной формы ГУС является вов лечение в патологический процесс не только капилляров, но и артериол и артерий, что проявляется выраженной злокачествен ной артериальной гипертензией. Пусковым моментом развития этой формы ГУС являются иммунные комплексы, которые вызывают внутрисосудистую активацию тромбоцитов. В основе поствакцинальной формы лежит повреждение эндотелиальной клетки ком плексом антиген — антитело с последующей внутрисосудистой аг регацией тромбоцитов.
Морфологические изменения в почках при ГУС различны и варьируют от картины острого микротромботического гломеру лонефрита до двустороннего некроза коры. Ранние гистопатологические изменения характеризуются отеком эндотелиальных кле ток, их отслоением от базальной мембраны, уменьшением про света капилляров. В последующем выявляются лейкоцитарные ин фильтраты и тромбы. Биопсия, выполненная у больных в более поздние сроки (более чем через 2 недели от начала заболевания), выявляет эктатические гломерулярные капилляры, набухшие эпи телиальные клетки, некрозы и тубулоинтерстициальные повреж дения.
В 1971 г. классификацию ГУС разработал Б. С. Каплан. Она ос нована на определении тяжести заболевания. Выделяют две фор мы: легкую и тяжелую, в каждой из которых различают два типа. Вне зависимости от формы и типа при диагностике ГУС должна присутствовать триада симптомов: анемия, Тромбоцитопения, азо темия:
• тип А — триада симптомов;
• тип Б — триада симптомов + судорожный синдром или арте риальная гипертензия;
2) тяжелая форма:
• тип А — триада симптомов + анурия длительностью более суток;
• тип Б — триада симптомов + анурия + артериальная гипертен зия и(или) судорожный синдром.
Данная классификация удобна тем, что позволяет определять лечебную тактику и ближайший прогноз.
В развитии ГУС выделяют три периода: продромальный, разга ра и восстановительный.
Продромальный период продолжается 2 — 7 сут. Он начинается с симптомов поражения ЖКТ или дыхательных путей, в последу ющем присоединяются неврологические расстройства разной сте пени выраженности в виде повышенной возбудимости, сменяю щейся прогрессирующей вялостью. К концу продромального пе риода кожа становится бледной, появляется олигурия.
Период разгара характеризуется тремя ведущими признаками: гемолитической анемией, тромбоцитопенией и ОПН.
А н е м и ч е с к и й с и н д р о м у больных развивается остро и характеризуется бледностью, желтушной окраской кожных покро вов, слизистых оболочек, склер.
Вследствие тромбоцитопении в клинической картине появля ется г е м о р р а г и ч е с к и й с и н д р о м в виде полиморфных вы сыпаний — от петехий до обширных экхимозов; могут возникать носовые кровотечения.
О л и г у р и ч е с к а я с т а д и я О П Н имеет особенности. В связи с большой потерей жидкости со стулом и путем перспирации при олигурической стадии ГУС наблюдается парадоксальная ситуация:
у больных имеет место внеклеточная гипогидратация при нали чии внутриклеточного отека. Для этой стадии болезни характерна гиперазотемия. У некоторых больных выявляется гиперволемия, обусловленная либо поздней диагностикой ОПН, либо неконт ролируемой Инфузионной терапией.
Тяжесть и длительность олигурической стадии зависят от глуби ны поражения почек и темпа регенерации клеток канальцевого эпи телия. При благоприятном течении в последующем возникает полиурическая стадия, продолжающаяся в течение 3 — 4 недель. Гипер азотемия исчезает к концу 1-й недели полиурической стадии.
Неврологические нарушения выявляются у половины детей с ГУС и отличаются большим разнообразием. У больных могут быть мышечные подергивания, гиперрефлексия, судороги, сопор, кома, Децеребрационная ригидность, гемипарезы. Появление этих сим птомов указывает на необходимость экстренного применения ге модиализа. Менингеальный синдром у больных ГУС, как прави ло, отсутствует. В то же время у части больных с гиперрефлексией и миотонией выявляется ригидность затылочных мышц и поло жительный симптом Кернига. На энцефалограмме (ЭЭГ) наблю даются диффузное снижение амплитуды волн или перемежающи еся пароксизмы сниженной активности и локальные изменения.
Нарушения деятельности сердечно-сосудистой системы про являются приглушенностью тонов сердца, тахикардией, экстра систолией. На верхушке сердца иногда выслушивается систоли ческий шум. Степень поражения миокарда соответствует выражен ности гиперкалиемии. Артериальное давление, сниженное в про дромальном периоде, за 2 — 3 сут до появления выраженных кли нических симптомов повышается вплоть до артериальной гипер тензии. Стойкая артериальная гипертензия является неблагопри ятным признаком. Вместе с метаболическими нарушениями она способна привести к сердечной недостаточности.
Соответственно тяжести метаболических расстройств и аци доза у больных появляется одышка. Над легкими выслушиваются жесткое дыхание, реже — мелкопузырчатые хрипы. Осложнени ем гипергидратации является отек легких. Рентгенологически в таком случае выявляется затемнение прикорневой зоны в виде силуэта бабочки со свободной от затемнения периферической зоны. Основным синдромом легочной недостаточности почти у всех больных ГУС, поступающих на лечение с внеклеточной ги пергидратацией, является синдром «ригидного легкого». Он про является интерстициальным отеком, требующим поведения ИВЛ.
Восстановительный период характеризуется постепенным вос становлением нарушенных функций организма.
Диагноз основывается на характерной клинической картине, развившейся на фоне острой кишечной или респираторной ин фекции, выявлении признаков ДВС-синдрома, внутрисосудис того гемолиза, тромбоцитопении, признаков ОПН. При вери фикации ГУС большую помощь оказывают результаты дополни тельных методов исследования. Изменения периферической крови зависят от периода заболевания и компенсаторных возможнос тей организма. В острый период выявляется выраженная анемия (чаще нормохромного характера). Концентрация гемоглобина в крови снижается до 60 — 80 г/л, иногда доходит до критических показателей — 30 — 40 г/л. Выявляются анизоцитоз и полихрома тофилия эритроцитов, компенсаторно увеличивается количество ретикулоцитов. Эритроциты приобретают искаженные фрагменти рованные формы в виде палочек, треугольников, дисков яичной скорлупы с фестончатыми краями. Осмотическая и механическая стойкость эритроцитов нормальны. Количество лейкоцитов, как правило, повышено до (20 • 10 9 /л) — (60 • 10 9 /л), характерен сдвиг лейкоцитарной формулы влево; количество тромбоцитов снижено.
Гемолитический характер анемии подтверждается наличием сво бодного гемоглобина в плазме крови, гемоглобинурией, повышени
ем уровня билирубина за счет неконъюгированной фракции. Общее количество билирубина повышается до 27,4—153,9 мкмоль/л и бо лее. Тест Кумбса у большинства больных отрицательный.
При биохимическом исследовании крови в соответствии с тя жестью почечной недостаточности выявляется высокое содержа ние остаточного азота, мочевины (выше 8,3 ммоль/л), креатини на (выше 110 мкмоль/л). Повышается уровень трансаминаз, отме чаются гипонатриемия, гипокальциемия, гиперкалиемия. Харак терна гипоальбуминемия (до 30,0— 17,6 г/л). У детей раннего воз раста гипоальбуминемия ниже 25 г/л является неблагоприятным прогностическим признаком.
Гемокоагуляционные изменения в периоде олигоанурии до на чала лечения аналогичны изменениям, выявляемым на I и II ста диях ДВС-синдрома, а в фазу гипокоагуляции, наблюдающуюся обычно в терминальный период, отмечаются изменения типич ные для ш и IV стадий ДВС-синдрома (см. подразд. 6.3). Выражен ные изменения гемокоагуляции обычно сочетаются с обширны ми кровоизлияниями на месте инъекций и тяжелыми кровотече ниями из респираторного тракта и ЖКТ.
В анализах мочи выявляются протеинурия, макро- и микроге матурия. При развитии гемолитической анемии за счет присут ствия гемоглобина моча приобретает коричневато-ржавый цвет. При ГУС в моче могут появляться фибриновые комки. Плаваю щие в моче рыхлые слизистые комки величиной от кукурузного зерна до лесного ореха белого или слегка розоватого цвета имеют большое значение в диагностике ГУС, поскольку появляются толь ко при этом синдроме.
При верификации диагноза следует ориентироваться на следу ющие критерии:
1) группой риска являются дети раннего возраста с кишечной инфекцией, протекающей с гемоколитом и абдоминальным син дромом;
2) ГУС следует подозревать при наличии у ребенка внезапно развившейся резкой бледности, снижения диуреза, появления симптомов поражения нервной системы;
3) диагноз практически становится бесспорным при выявле нии триады симптомов: регенераторной гемолитической анемии, тромбоцитопении и азотемии.
Гемолитико-уремический синдром, развившийся на фоне ки шечной инфекции, в олигоанурическую фазу необходимо диф ференцировать с тяжелой степенью дегидратации при кишечных токсикозах. В том и другом состоянии может развиться ОПН. Од
нако тяжелая степень дегидратации при кишечном токсикозе не сопровождается гемолитической анемией.
Терапия ГУС зависит от периода заболевания и тяжести пора жения почек. Комплекс лечебных мероприятий включает патоге нетическую, симптоматическую и заместительную терапию.
Патогенетические лечебные мероприятия включают:
1) воздействие на агрегатное состояние крови назначением антиагрегантов — дипиридамол а из расчета 5 мг/кг в сутки;
2) назначение витаминов Е и А с целью коррекции антиоксидантного статуса;
Вместе с тем отношение к гепаринотерапии при лечении ГУС неоднозначно. Среднемолекулярный гепарин в лечении ГУС ис пользуют многие врачи, хотя больные нередко выздоравливают и без его применения. Тем не менее общая летальность при ГУС значительно снижается при включении в комплекс терапии этого препарата. Гепарин назначают в дозе 300 — 500 ЕД/кг в сутки, при этом стремятся добиться удлинения времени свертывания крови в 3 раза по сравнению с нормой. Помимо этого в лечении использу ют антитромбин III и свежезамороженную плазму как источник антитромбина III.
При подозрении на D – Г У С как можно раньше следует прибе гать к обменному плазмаферезу.
Лечение е период анурии состоит из коррекции водно-элект ролитных расстройств, подавления катаболизма и инфекционно го процесса. Оно включает антианемическую терапию, методы внепочечной детоксикации и симптоматические средства. В целом терапия в период анемии при ГУС проводится по принципам ле чения ОПН.
По мнению большинства исследователей при ГУС (вне зависи мости от степени уремии) необходимо как можно ранее прово дить гемодиализ. Он показан ежедневно на протяжении всего пе риода олигоанурии.
Показаниями для гемодиализа при ГУС являются:
• анурия более суток;
• быстрое нарастание уровня мочевины (более 6 ммоль/л в сут
• длительная олигурия с артериальной гипертензией;
• быстро прогрессирующий гемолиз;
• гиперволемия с признаками сердечной недостаточности;
• гиперкалиемия (более 6 ммоль/л) и метаболический ацидоз, не корригируемый консервативной терапией.
В последние годы при лечении ГУС стал часто использоваться перитонеальный диализ. При невозможности провести гемодиа лиз рекомендуется осуществлять заменные переливания крови, многократные промывания желудка и кишечника. Заменные пе реливания крови необходимо проводить максимально рано. При снижении концентрации гемоглобина ниже 65 — 70 г/л показана трансфузионная терапия свежегепаринизированной кровью (из расчета 3 — 5 мл/кг).
Наряду с антикоагулянтной и антиагрегантной терапией мож но использовать фибринолизин или стрептокиназу (500 — 1 ООО ЕД 1 раз в сутки) в течение 2 — 4 сут. Терапию ГКС при лечении ГУС большинство исследователей отвергает. При ГУС, развившемся на фоне бактериальной инфекции, назначают антибиотики, не обладающие нефрогепатотоксическими свойствами. Вместе с тем следует помнить, что назначение антибиотиков при острой ки шечной инфекции, вызванной Е. coli 0157 :Н7, может способ ствовать высвобождению веротоксина, существенно повышая та ким образом риск развития ГУС.
В полиурическую фазу необходимо корригировать потери воды
и электролитов. При осложненных вариантах ГУС в лечении пред лагают использовать препараты, содержащие иммуноглобули ны.
При ГУС прогноз серьезен. На момент первого описания забо левания в 1955 г. ГУС практически являлся фатальным. К насто ящему времени летальность составляет 3 —5 %, однако в развива ющихся странах она остается высокой, достигая 72 %. Пациенты с Б + -ГУС имеют лучший исход по сравнению с больными D-ГУС, при котором наблюдаются рецидивы и высокая летальность. Не благоприятный прогноз наблюдается при наличии следующих признаков:
1) возраст менее 6 мес и старше 4 лет (в том и другом случае это связано с высокой вероятностью развития D-ГУС);
2) продрома в виде ОРВИ;
3) длительно сохраняющаяся Тромбоцитопения; высокий ней
4) наследственный характер заболевания;
5) раннее развитие артериальной гипертензии;
6) судороги и кома;
7) анурия свыше 3 недель.
Исходом ГУС является хронический интерстициальный нефрит с развитием хронической почечной недостаточности. При Б + -ГУС прогноз благоприятен.
О л и г у р и ч е с к а я с т а д и я О П Н имеет особенности.
Гемолитико-уремический синдром (ГУС) у детей
ГЕМОЛИТИКО-УРЕМИЧЕСКИЙ СИНДРОМ (ГУС) является одной из частых причин острой почечной недостаточности (ОПН) у детей.
ТРИАДА СИМПТОМОВ:
- Гемолитическая анемия (снижение уровня гемоглобина и эритроцитов в крови, с наличием фрагментированных эритроцитов – шизоцитов)
- Тромбоцитопения – снижение уровня тромбоцитов в крови
- Острая почечная недостаточность
У большинства (90-95%) детей отмечается так называемый типичный или постдиарейный ГУС (Д+ГУС).
Другая форма ГУС, называемая атипичный (аГУС), встречается гораздо реже (5-10 % всех случаев) и является результатом аномалии (чаще генетической) белков, регулирующих процесс активации комплементов.
Д+ГУС ИЛИ ПОСТДИАРЕЙНЫЙ ГУС
Д+ГУС развивается вследствие кишечной инфекции вызванная Е coli (кишечная палочка) которая продуцируют токсин – шигатоксин (STEC).
тмечается в основном в возрасте до 3 лет и редко до 6 месяцев.
Симптомы
- диарея (разжиженный стул, понос) в течение нескольких дней (у 90-95%). Иногда бывает кровь в стуле. ЕСЛИ ВЫ ЗАМЕТИЛИ КРОВЬ В СТУЛЕ, НЕЗАМЕДЛИТЕЛЬНО ОБРАТИТЕСЬ К ВРАЧУ.
- рвота (у 30-60%) и боли в животе
Манифестация ГУС начинается в среднем через 6 (в среднем 2-14) дней. Бледность, общее недомогание, слабость, изменение поведения, небольшая желтушность, уменьшение количества мочи после (кровавой) диареи должны насторожить врача в отношении ГУС.
ЕСЛИ У ВАШЕГО РЕБЕНКА КИШЕЧНАЯ ИНФЕКЦИЯ И ЧЕРЕЗ НЕСКОЛЬКО ДНЕЙ ВЫ ЗАМЕТИЛИ ТЕМНУЮ МОЧУ (КРАСНУЮ) С УМЕНЬШЕНИЕМ ЕЕ КОЛИЧЕСТВА, ИЛИ ЗАМЕТИЛИ ПАСТОЗНЫЕ ВЕКИ ИЛИ ОТЕК ЛИЦА, БЛЕДНОСТЬ С ЖЕЛТУШНОСТЬЮ НЕ ЗАМЕДЛЕТЕЛЬНО ОБРАТИТЕСЬ К ВРАЧУ!
РАЗВЕРНУТАЯ КАРТИНА ГУС
- гемолитическая анемия (снижение гемоглобина, шизоциты)
- тромбоцитопения
- лейкоцитоз
ОПН с повышением уровня сывороточного креатинина и азота мочевины. Приблизительно половина пациентов имеют тяжелую олигурию (снижение количества мочи) или анурию (полное отсутствие мочи), 50-60% нуждаются в остром диализе. При наличии хоть какого-нибудь количества мочи постоянно определяются микро- или макрогематурия (кровь в моче) и протеинурия (белок в моче).
ВНЕПОЧЕЧНЫЕ ОСЛОЖНЕНИЯ
- поражение центральной нервной системы
- поражение желудочно-кишечного тракта (воспаление толстого кишечника – колит и др.)
- отек поджелудочной железы
- поражение печени
- сердечные осложнения
Для уточнения диагноза срочно должны быть проведены соответствующие лабораторные исследования и незамедлительно начать лечение.
ПРОГНОЗ
В большинстве случаев в течение менее чем 1-2х недель исчезают гемолитическая анемия и тромбоцитопения, нормализуется диурез. 10% детей в среднем в течение 4-х месяцев достигают терминальной ХПН. Смертность в основном в результате поражения ЦНС (центральной нервной системы).
СОВЕТЫ РОДИТЕЛЯМ
ПРЕДОТВРАЩЕНИЯ ИНФИЦИРОВАНИЯ STEC (кишечная палочка содержащий шигатоксин) и развития ГУС
- рубленая говядина должна быть хорошо прожарена до приобретения на разрезе серого цвета
- дети до 3 лет не должны употреблять непастеризованные продукты (молоко, сыр, фруктовые соки)
- до приготовления пищи, особенно после манипуляций с рубленой говядиной, необходимо мыть руки
- дети, которые прикасались к крупному рогатому скоту и другим животным, должны после этого умыться, а также перед едой.
- для предотвращения контаминации мяса кишечным содержимым необходим контроль убоя скота. Важен надлежащий надзор и уход за водоснабжения
- антибиотики? Многочисленные исследования показали, что антибиотикотерапия в период диареи увеличивает риск развития ГУС, возможно в связи с освобождением шигатоксина в результате лизиса бактерий. Тем не менее, этот риск пока не доказан.
Для получения больше информации звоните врачам отделения: + 7(499) 134-07-43
Д ГУС развивается вследствие кишечной инфекции вызванная Е coli кишечная палочка которая продуцируют токсин шигатоксин STEC.





